- イオンの概要
- 陽イオンと陰イオン
- イオン化エネルギーと電子親和力
- イオン化エネルギー・電子親和力と熱化学方程式(+α)
イオンとイオンの生成
イオンとは?
すべて物質は、より安定な形に変わろうとする性質があります。
原子も同様に、様々な方法でより安定になろうとします。その1つがイオンになることです。
イオン:電子を失う・受け取ることにより電気を帯びている粒子、陽イオンと陰イオンがある。
電子を失うと全体が正に帯電した陽イオン、電子を受け取ると全体が負に帯電した陰イオンになります。
また、原子が陽イオンになる性質のことを陽性、原子が陰イオンになる性質を陰性といいます。
なぜ安定化するのか
なぜイオンになると安定するのでしょうか。その答えは貴ガスと同じ電子配置になるからです。
前回紹介した通り、貴ガスは閉殻で反応性に乏しい(=安定)です。イオンになる原子は、原子番号が近い貴ガス原子の電子配置をとります。
ナトリウムを例にとってみます。
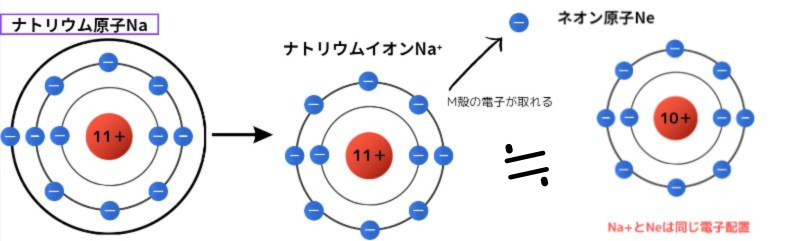
上図のように、ナトリウムは電子を1つ放出してネオン原子と同じ電子配置のナトリウムイオンになります。
陰イオンの場合は、足りない電子を受け取って貴ガスと同じ電子配置をとります。
イオンの表し方
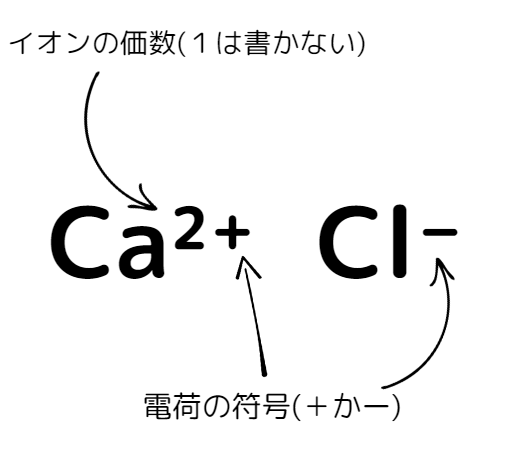
イオンは、イオン式を用いて表します。
イオン式で表すのは、イオンの価数(失う・受け取る電子の数)と電荷(±)です。
イオン化エネルギーと電子親和力
イオンへのなりやすさ
どの原子もイオンになるわけではありません。イオンになりやすい原子となりにくい原子があります。
では、「イオンへのなりやすさ」とは何で決まるのでしょうか?そこで登場するのがイオン化エネルギーと電子親和力です。
- イオン化エネルギー:1つの電子を放出して一価の陽イオンになるために吸収するエネルギー、小さいほど陽イオンになりやすい。
- 電子親和力:1つの電子を受け取って一価の陰イオンになるために放出するエネルギー、大きいほど陰イオンになりやすい。
エネルギー放出・吸収の理由
イオン化エネルギーは陽イオンになるために吸収するエネルギー、電子親和力は陰イオンになるために放出するエネルギーと説明しましたが、どうしてこのような関係になるのでしょうか?
陽イオンとエネルギー吸収
陽イオンになるためには、余っている電子を放出する必要があります。このとき電子は、中心の陽子があることにより静電気力を受けることになります。
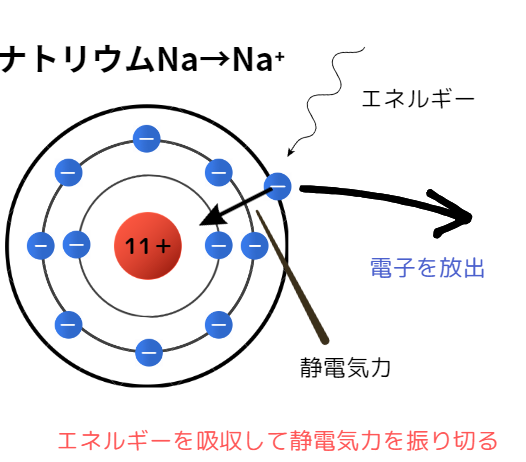
この静電気力を振り切って電子を放出するため、陽イオンになるためにはエネルギー(イオン化エネルギー)が必要なわけです。
陰イオンとエネルギー放出
陰イオンになるためには、電子を吸収する必要があります。先ほど使った静電気力を考えると、電子を受け取る際にエネルギーは必要なさそうです。
ではなぜエネルギーが放出されるのか、それは電子が電子殻に入る際余分なエネルギーが発生するからです。
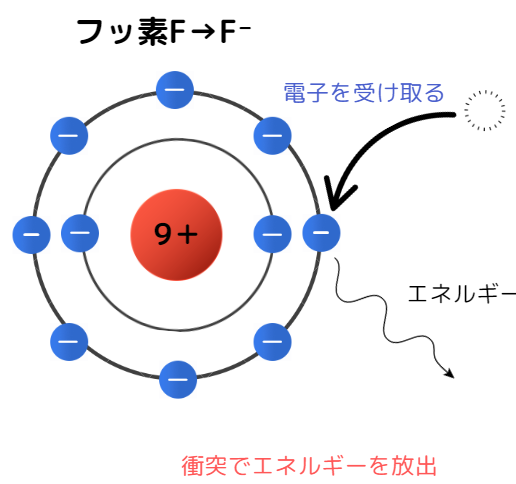
例えば、隕石が地球に衝突したら衝突面から熱や光が発生することは容易に想像できると思います。
厳密に言えば、隕石の例と電子は違うのですが、ほとんど同じことが起こっているのです。
電子が電子殻と衝突すると余分なエネルギーが放出される、このエネルギーこそが電子親和力なのです。
+α
イオン化エネルギー・電子親和力と熱化学方程式
化学で学習する熱化学方程式を使うと、イオン化エネルギーと電子親和力を数字で確認することができます。
ナトリウムイオンになる反応
Na(気) = Na⁺(気) + e⁻ ⊿H=496kj
塩化物イオンになる反応
Cl(気) + e⁻ = Cl⁻(気) ⊿H=-349kj



コメント