- イオン結合・結晶
- 組成式
- イオンからなる物質の性質
- イオン結晶の構造(+α)
- 水素イオンがイオン結合しない理由(+α)
イオン結合とイオン結晶
イオン結合
イオン結合:静電気力(クーロン力)によって、陽イオンと陰イオンの間にできる化学結合
例えば、ナトリウムイオンNa⁺と塩化物イオンCl⁻では、下図のようにイオン結合します。
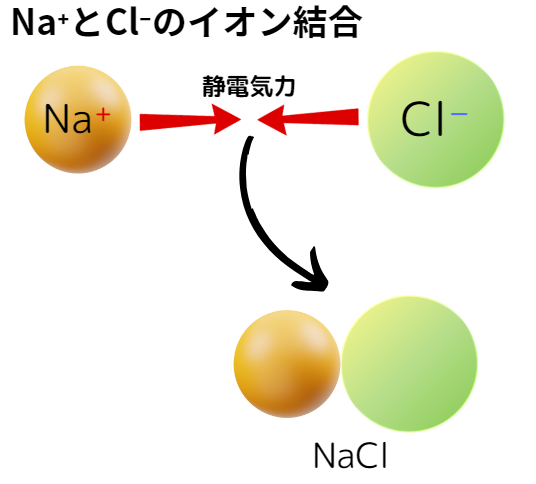
一般的にイオン結合は、陽性の強い金属元素と陰性の強い非金属元素の間で起こります。
(例外:アンモニウムイオンNH₄⁺と塩化物イオンCl⁻はイオン結合により、塩化アンモニウムNH₄Clを作ります。)
イオン結晶
まず、結晶の定義についておさらいしましょう。
結晶とは、粒子が規則正しく周期的な配列で構成された固体のことです。身の回りでは、雪や水晶、食塩などは結晶です。
結晶の中でも、イオン結合で出来ている結晶をイオン結晶といいます。
下図は、塩化ナトリウムの例です。
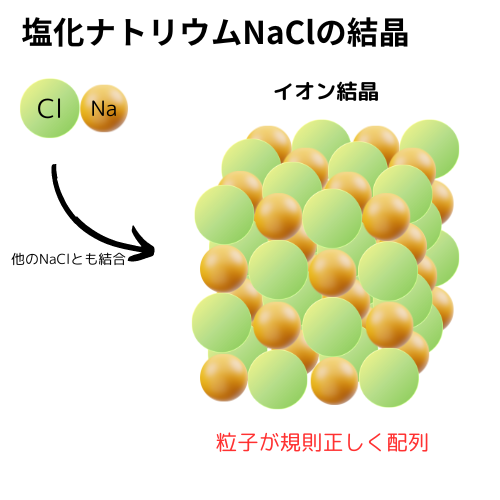
実物の塩化ナトリウムは、上図の構造が大量に集まったものです。
イオンからなる物質の表し方
イオンからなる物質(イオン結晶など)は、陽イオンと陰イオンから成り電気的に中性です。
そのため、イオンからなる物質の電荷は0になります。
例えば、二価の陽イオンであるCa²⁺と一価の陰イオンであるCl⁻がイオン結合すると、次のようになります。
イオン反応式 Ca²⁺ + 2Cl⁻ = CaCl₂
電荷 (+2) + 2(-1) = 0
(イオン反応式は後に詳しく勉強します。)
また、イオンからなる物質は組成式を使って表します。
組成式:成分元素の原子の数を最も簡単な整数比にした化学式
先ほどの塩化ナトリウムの結晶を見た通り、イオン結晶は特定の数の粒子が集まってできているわけではありません。ナトリウムと塩素のペアが、無数にくっついて結晶を作っています。
そのため塩化ナトリウムNaClは、最も簡単な整数比(1:1)で表されます。
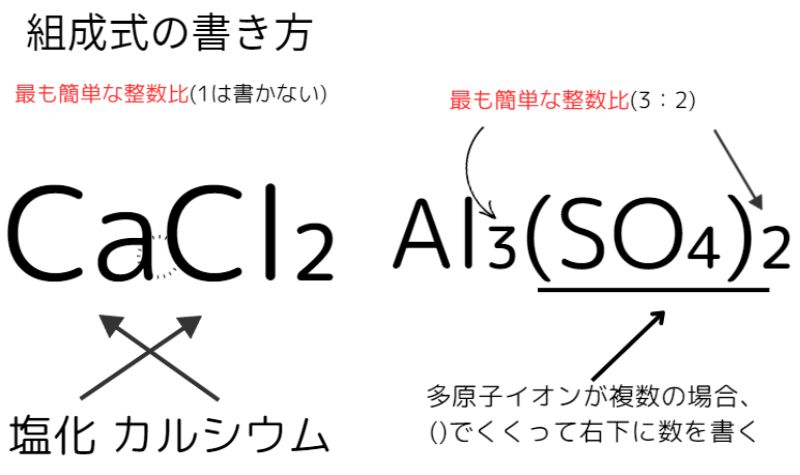
組成式の書き方の規則は次の3つです
- 原子の数を最も簡単な整数比にする(1は書かない)
- 陽イオンを先に、陰イオンを後に書く(名称と逆)
- 同じ多原子イオンが複数ある場合、()で囲んで右下に数を書く…例:硫化アルミニウムAl₃(SO₄)₂
イオンからなる物質の性質
イオンからなる物質の特徴は、主に3つあります。
- 融点・沸点が高く、硬い
- イオン結晶は割れやすくもろい
- 結晶は電気を導かないが、融解液・水溶液は電気を導く
それぞれ詳しく見ていきます。
融点・沸点が高く、硬い
静電気力によるイオン結合は、比較的結合力が強いです。
粒子同士がより結合しようと集まるため、融点が高く(液体より固体のままでいやすく)、沸点が高い(気体より液体のままでいやすい)です。
また、結晶が硬いのもイオン結合が強いためです。
イオン結晶は割れやすくもろい
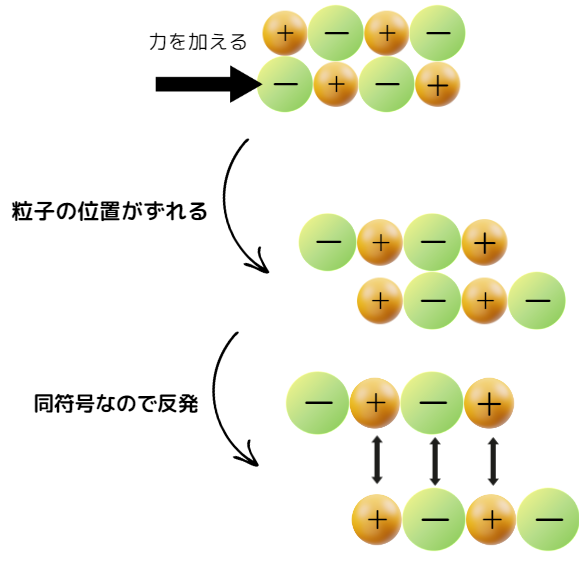
イオン結晶は硬いですが、割れやすくもろい性質があります。
そのため、イオン結晶に強い力を加えると簡単に割れてしまいます。
その原因は、イオン結晶の構造にあります。
イオン結晶に力を加えると、陽イオンと陰イオンの位置関係がずれてイオン同士が反発します。
結晶は電気を導かないが、融解液・水溶液は電気を導く
イオン結晶は中性のため、電気を導きません。
しかし、イオン結晶を溶かして液体にするか、水に溶かすかすることでイオンが自由に動けるようになり、電気を導くようになります。
(物質の三態における粒子の動きと同じ)
このように、物質がイオンに分かれることを電離といい、水に溶けた解きに電離する物質を電解質、電離しない物質を非電解質と呼びます。
+α
イオン結晶の構造
イオン結晶の構造は「化学」で詳しく学ぶので、ここでは紹介だけします。
イオン結晶の構造は複数ありますが、高校化学で出てくる構造は主に4つです。
イオン結晶の構造の種類
・塩化ナトリウムNaCl型
・塩化セシウムCsCl型
・硫化亜鉛ZnS型(閃亜鉛鉱型)
・フッ化カルシウムCaF₂型(蛍石型)
水素イオンがイオン結合しない理由
イオン結合する陽イオンは金属元素と前述しましたが、水素も陽イオンになります。
塩化水素HClなどのように、水素イオンも陰イオンと結合しますがその結合はイオン結合ではありません。後に学ぶ共有結合に分類されます。
その理由には、水素が電子を引き付ける力が関係しています。
原子には、それぞれ特有の電子の引き付けやすさ(電気陰性度)を持っています。水素は、電子の引き付けやすさがが比較的大きいため陰イオンに電子を完全に渡すことができません。
(ただし電気陰性度の大きさは、H<Cl)
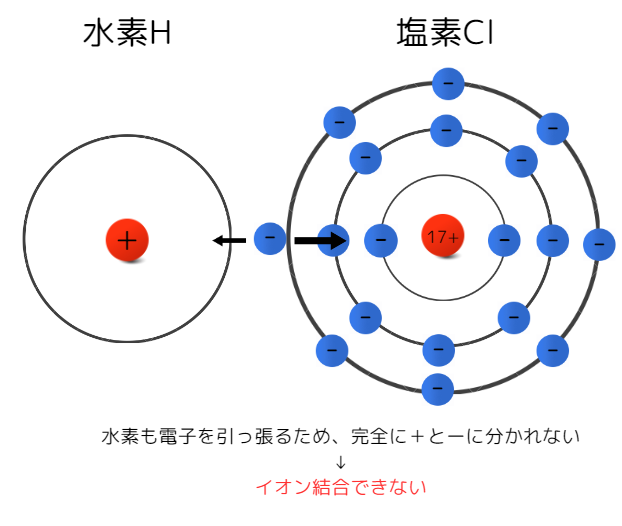
以上の要因により、水素はイオン結合ができません。


