- ヨウ素滴定の原理
- ヨウ素滴定の問題の解き方
(※この記事における「ヨウ素」は元素のことを表しています。ヨウ素分子のときはI₂、ヨウ素イオンのときはI⁻を表記していますのでご理解ください。)
準備:ヨウ素滴定に入る前に
ヨウ素を使って行う酸化還元滴定をヨウ素滴定と呼びます。
この記事では、ヨウ素滴定の原理と問題の解き方について分かりやすく解説します。
まず、ヨウ素滴定を解説する準備として、「ヨウ素が用いられる理由」「ヨウ素滴定で使われる物質」「ヨウ素滴定の種類」について説明します。
ヨウ素が用いられる理由
酸化還元滴定にヨウ素が用いられる理由は主に2つあります。
- 酸化剤と還元剤の両方にはたらく
酸化剤:I₂ → 2I⁻ + 2e⁻
還元剤:2I⁻ + 2e⁻ → I₂ - ヨウ素デンプン反応により反応の終点が視覚的にわかる
ヨウ素溶液にデンプンを加えると青紫色に変化する反応
ヨウ素滴定の種類
ヨウ素滴定には、ヨウ素酸化滴定(ヨージメトリー)とヨウ素還元滴定(ヨードメトリー)の2種類に分けられます。
簡単に説明すると次のようになります。
ヨウ素が酸化剤としてはたらく→ヨウ素酸化滴定(ヨージメトリー)
ヨウ素が還元剤としてはたらく→ヨウ素還元滴定(ヨードメトリー)
ヨウ素滴定は計算問題や反応式を問う問題として出題されるため、これらの名称を覚える必要はありません。原理を理解し、問題を解けるようになることが重要です。
ヨウ素滴定で使われる物質と用途
ヨウ素滴定で用いいられる物質の用途・はたらきを簡単にまとめます。

なお、チオ硫酸ナトリウムの反応式・半反応式は問題文で与えられるため、名称とは用途・はたらきを覚えておきましょう。
ヨウ素酸化滴定の手順と原理
ヨウ素酸化滴定は次のように滴定していきます。
- ヨウ素溶液に定量したい還元剤を加える
- デンプンを加え、残ったヨウ素をチオ硫酸ナトリウムで滴定する
- 溶液が青紫色→無色になったところで反応を終える
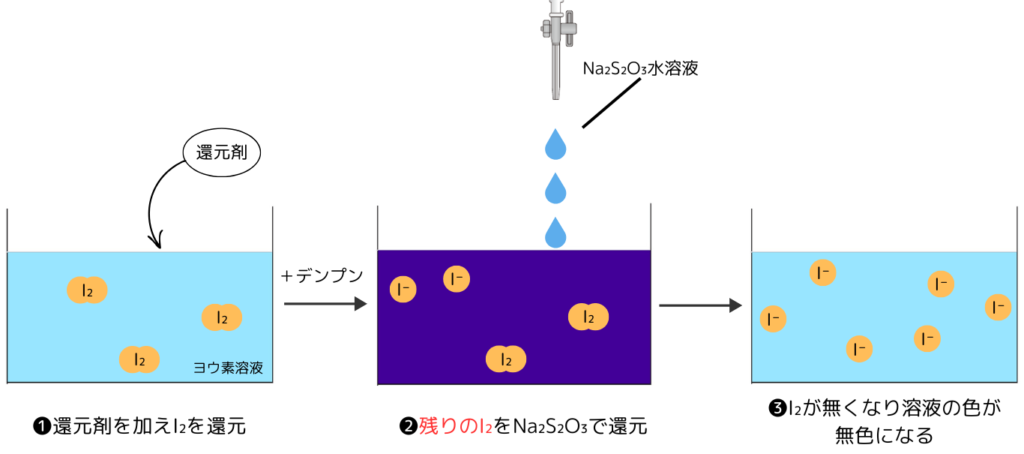
残ったヨウ素を滴定するため、ヨウ素酸化滴定は酸化還元反応における逆滴定の1つです。
そのため、次の関係が成り立ちます。
(I₂が受け取るe⁻の物質量) = (還元剤が失う電子の物質量) + (Na₂S₂O₃が失うe⁻の物質量)

酸塩基における逆滴定はこちらで解説しています。
参考:中和滴定(量的関係・滴定曲線・ガラス器具・逆滴定・二段階中和など)
ヨウ素還元滴定の手順と原理
ヨウ素還元滴定は次のように滴定していきます。
- ヨウ化カリウムの硫酸酸性水溶液に定量したい酸化剤を加える
- デンプンを加え、遊離したヨウ素をチオ硫酸ナトリウムで滴定する
- 溶液が青紫色→無色になったところで反応を終える
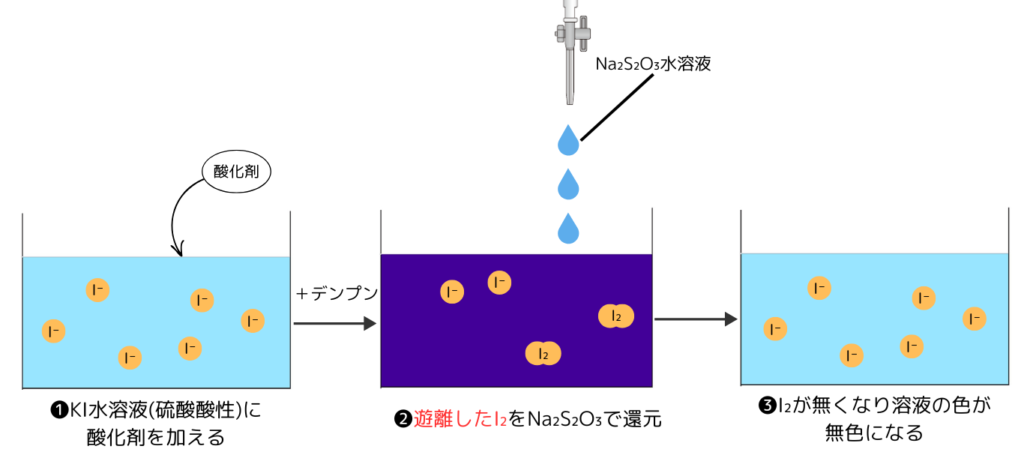
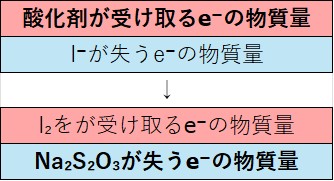
遊離したヨウ素を滴定するため、次の関係式が成り立ちます。
酸化剤が受け取るe⁻の物質量=I⁻が失うe⁻の物質量
=I₂が受け取るe⁻の物質量=Na₂S₂O₃が失うe⁻の物質量
ヨウ素滴定の問題
ヨウ素酸化滴定
問:1.0mol/Lのヨウ素溶液50mLに、二酸化硫黄を通して完全に吸収させた。この溶液にデンプンを加え、0.50mol/Lのチオ硫酸ナトリウム水溶液で滴定していくと、20mL加えたところで溶液の色が変化した。吸収させた二酸化硫黄の物質量を求めよ。ただし、チオ硫酸ナトリウムとヨウ素は、次のように反応するものとする。
I₂ + 2Na₂S₂O₃ → 2NaI + Na₂S₄O₆
【解説】
二酸化硫黄の物質量をx molとします。
それぞれの半反応式をまとめます。
- ヨウ素:I₂ + 2e⁻ → 2I⁻
- 二酸化硫黄:SO₂ + 2H₂O → SO₄²⁻ + 4H⁺ + 2e⁻
- チオ硫酸イオン:2S₂O₃²⁻ → S₄O₆²⁻ + 2e⁻
(I₂が受け取るe⁻の物質量) = (SO₂が失う電子の物質量) + (Na₂S₂O₃が失うe⁻の物質量)の関係から次のように求められます。
2 × 1.0mol/L × \(\frac{50}{1000}\)L = 2 × 0.50mol/L × \(\frac{20}{1000}\)L + 2 × x mol
x =4.0×10⁻²mol
ヨウ素還元滴定
濃度未知の過酸化水素水50mLに、過剰のヨウ化カリウムの硫酸酸性溶液を加えるとヨウ素が遊離した。この溶液にデンプンを加え、0.1mol/Lのチオ硫酸ナトリウム水溶液で滴定していくと、15mL加えたところで溶液の色が変化した。もとの過酸化水素水のモル濃度を求めよ。ただし、チオ硫酸ナトリウムとヨウ素は、次のように反応するものとする。
I₂ + 2Na₂S₂O₃ → 2NaI + Na₂S₄O₆
【解説】
もとの過酸化水素水のモル濃度をy mol/Lとし、
H₂O₂とKIの反応を反応1、I₂とNa₂S₂O₃の反応を反応2とします。
反応1の半反応式は次のようになります。
- 酸化剤:H₂O₂ + 2H⁺ + 2e⁻ → 2H₂O
- 還元剤:2I⁻ → I₂ + 2e⁻
- 反応式:2KI + H₂O₂ + H₂SO₄ → I₂ + 2H₂O + K₂SO₄
ここで、H₂O₂とI₂の係数比は1:1であり、KIが過剰なのでH₂O₂の物質量=遊離したI₂の物質量となります。
(※反応2は問題文で与えられていますが、導出過程も記しておきます。)
次に、反応2の半反応式は次のようになります。
- 酸化剤:ヨウ素:I₂ + 2e⁻ → 2I⁻
- 還元剤:チオ硫酸イオン:2S₂O₃²⁻ → S₄O₆²⁻ + 2e⁻
- 反応式:I₂ + 2Na₂S₂O₃ → 2NaI + Na₂S₄O₆
ここで、I₂とNa₂S₂O₃の係数比は1:2であるため、I₂の物質量×2=Na₂S₂O₃の物質量となります。
以上より、H₂O₂のモル濃度は「H₂O₂の物質量×2=Na₂S₂O₃の物質量」で求めることが出来ます。
2 × y mol/L × \(\frac{50}{1000}\)L = 0.1mol/L × \(\frac{15}{1000}\)L
y = 1.5×10⁻²mol/L


