- 中和反応
- 塩の分類
- 塩の水溶液の液性
- 弱酸・弱塩基・揮発性酸遊離
- 揮発性酸遊離の詳細(+α)
中和反応
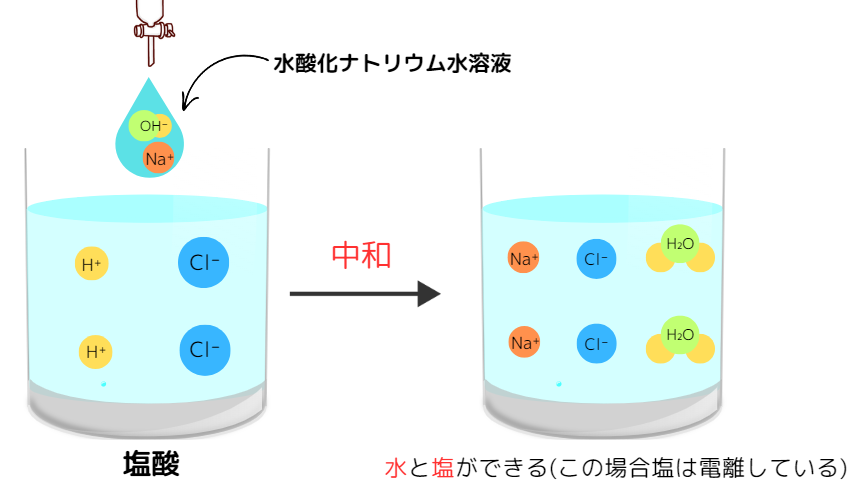
酸と塩基が反応すると、互いの性質を打ち消し合う中和反応が起こります。
一般に、中和反応が起こると酸の水素イオンH⁺と塩基の水酸化物イオンOH⁻から水H₂Oが生じ、酸の陰イオンと塩基の陽イオンから塩が生じます。
具体例として、塩酸と水酸化ナトリウム水溶液の反応が挙げられます。
HCl(酸) + NaOH(塩基) → NaCl(塩) + H₂O
(水溶液中の場合:NaCl → Na⁺ + Cl⁻)
ただし、例外としてOHを持たないアンモニアNH₃と酸の中和反応は水が生じません。
HCl + NH₃ → NH₄Cl
塩
塩とその分類
先ほど出てきた塩について詳しく見ていきます。
塩:酸の陰イオンと塩基の陽イオンからなる化合物
塩は3種類「酸性塩・塩基性塩・正塩」に分類する事ができます。
| 分類 | 組成 | 例 |
|---|---|---|
| 酸性塩 | 酸由来のHが残っている塩 | ・NaHCO₃ ・NaH₂PO₄ |
| 塩基性塩 | 塩基由来のOHが残っている塩 | ・MgCl(OH) ・Cu₂CO₃(OH)₂ |
| 正塩 | HもOH残っていない塩 | ・NaCl ・CH₃COONa |
※この分類は塩の組成を区別するための分類であるため、それぞれが必ずしも酸性・塩基性・中性を示すわけではありません。
塩の水溶液の性質
正塩の水溶液の性質(正塩の液性)は、正塩の組成から判別する事ができます。
| 分類 | 水溶液の性質 | 例 |
|---|---|---|
| 強酸+強塩基 | 中性 | ・HCl(塩酸+水酸化ナトリウム) ・KNO₃(硝酸+水酸化カリウム) |
| 強酸+弱塩基 | 酸性 | ・NH₄Cl(塩酸+アンモニア) ・CuSO₄(硫酸+水酸化銅(Ⅱ)) |
| 弱酸+強塩基 | 塩基性 | ・Na₂CO₃(炭酸+水酸化ナトリウム) ・CH₃COONa(酢酸+水酸化ナトリウム) |
「酸性塩・塩基性塩・弱酸+弱塩基の正塩」の水溶液の性質には規則性がないため、組成から予測することはできません。(酸性塩については、後に化学で学習する”加水分解”を考えることで一部理解することができます。)
塩と酸・塩基の反応
弱酸の遊離
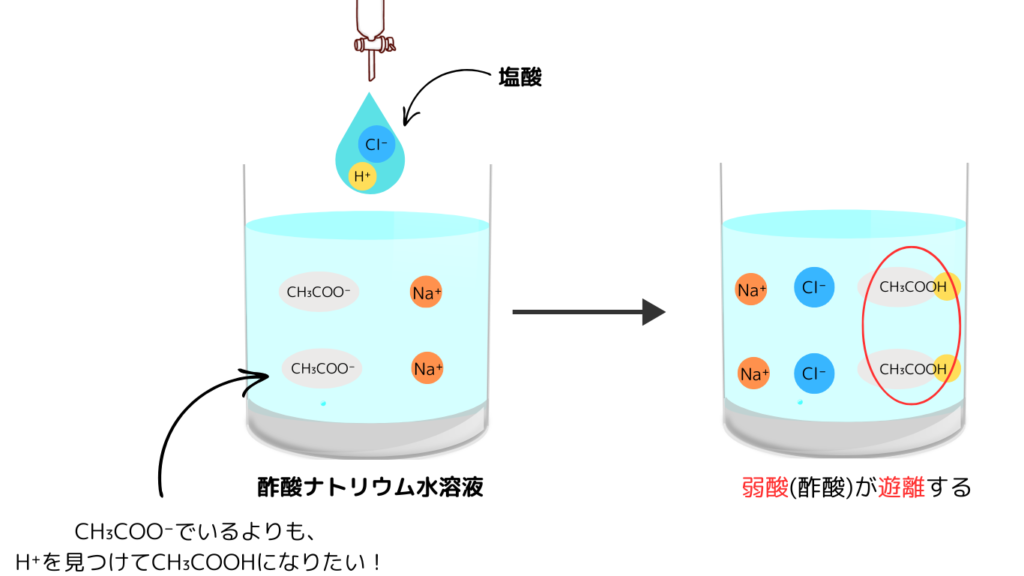
弱酸の塩と強酸を反応させると、弱酸が生成します。これを弱酸遊離といいます。
具体例として、酢酸ナトリウムと塩酸の反応が挙げられます。
CH₃COONa(弱酸の塩) + HCl(強酸) → NaCl + CH₃COOH(弱酸)
弱酸遊離の原因は、弱酸の電離度が小さいことにあります。
以下は、酢酸を例に解説します。
CH₃COOH ⇄ CH₃COO⁻ + H⁺
酢酸は、電離度が0に近いほど小さいためH⁺をあまり放出しない弱酸でした。
これは、「電離しづらい→CH₃COO⁻+H⁺よりもCH₃COOHの方が安定」と言い換えることができます。
ここで、先程の弱酸遊離の反応に戻ります。
反応前において、酢酸ナトリウムは電離しCH₃COO⁻とNa⁺に分かれています。
そこに塩酸を滴下すると水溶液中にH⁺が水溶液中に現れると、上の言い換えからCH₃COO⁻はH⁺と結合してCH₃COOHを作る(遊離する)わけです。
弱塩基の遊離
弱塩基の塩と強塩基を反応させると、弱塩基が生成します。これを弱塩基遊離といいます。
具体例として、塩化アンモニウムと水酸化ナトリウムの反応が挙げられます。
NH₄Cl(弱塩基の塩) + NaOH(強塩基) → NaCl + NH₃(弱塩基) + H₂O
こちらも、弱酸遊離のときと原理は同じです。
揮発性の酸の遊離
物質の中には、揮発性と呼ばれる性質をもつものがあります。
揮発性:常温で気体になりやすい性質。反対に、常温で気体になりにくい性質を不揮発性という。
揮発性の酸には「塩酸・硝酸・酢酸など」があり、不揮発性の酸には「硫酸・リン酸など」があります。
揮発性の酸の塩と不揮発性の酸を反応させると、揮発性の酸が生成します。これを揮発性酸遊離といいます。
具体例として、塩化ナトリウムと濃硫酸の反応が挙げられます。
NaCl(揮発性の酸の塩) + H₂SO₄(不揮発性の酸) → NaHSO₄ + HCl(揮発性の酸)
(反応には加熱が必要)
なお、高校化学でよく出題されるの揮発性酸遊離は、この反応とフッ化水素を生成する反応だけです。 (CaF₂ + H₂SO₄ → 2HF + CaSO₄)
+α
揮発性酸遊離の詳細
揮発性酸遊離の原理
揮発性酸遊離自体あまり問われるものではありませんが、ぜひ原理を知っておきましょう。
揮発性酸遊離は「弱酸遊離」が元になっています。
まず、知っておくべきことは塩酸・希硫酸・濃硫酸の強さの順位です。
”ブレンステッド・ローリーの定義による酸”で考えると、酸としての強さ(水素イオンを与えようとする強さ)の大小は「濃硫酸>塩酸>希硫酸」となります。
そのため「濃硫酸=強酸 塩酸=弱酸」とみなすことができ、弱酸遊離の形にあてはめることができます。
NaCl(弱酸の塩) + H₂SO₄(強酸) → NaHSO₄ + HCl(弱酸)
NaHSO₄までしか反応しない理由
硫酸は2価の酸なので、一見すると次のように反応しそうに思えます。
2NaCl + H₂SO₄ → Na₂SO₄ + 2HCl
しかし、実際はこの化学反応が起きることはありません。その理由は硫酸が2段階電離することにあります。
1段階:H₂SO₄ → H⁺ + HSO₄⁻
2段階:HSO₄⁻ → H⁺ + SO₄²⁻
1と2の式を足せば、普段見る硫酸の電離式が出てきます。
酸としての強さの大小は「H₂SO₄(1段階)> HCl >HSO₄⁻(2段階)」のようになります。
1段階目の電離のみが起きるため、生成物はNaHSO₄になります。


