- 中和反応と量的関係
- 中和滴定とガラス器具
- 滴定曲線
- 逆滴定と二段階中和(+α)
中和反応の量的関係
中和反応の量的関係
酸と塩基が過不足なく中和するとき、その混合溶液は中性となり水素イオンH⁺の物質量と水酸化物イオンの物質量が等しくなります。
したがって、次の関係式が成り立ちます。
酸の(物質量) × (価数) = 塩基の(物質量) × (価数)
(H⁺の物質量 = OH⁻の物質量)
例題で、上の関係式を使ってみましょう。
問:希硫酸0.5molを過不足なく中和するたに必要な水酸化ナトリウムは何molか。
解答:タップで表示
必要な水酸化ナトリウムをxmolとすると、上の関係式から
0.5mol × 2 = xmol × 1
x = 1mol
酸・塩基の強弱と中和反応の量的関係
強酸に比べて弱酸は[H⁺]が小さいため、中和に必要なOH⁻の物質量は少なくなる様に思えます。
しかし、中和する酸・塩基の物質量は酸・塩基の強さ(電離度)に関係ありません。
酢酸と水酸化ナトリウムとの中和を例に説明します。
酢酸は水溶液中でわずかに電離しています。
CH₃COOH ⇄ CH₃COO⁻ + H⁺
水酸化ナトリウム水溶液を少しずつ加えていくと、電離したH⁺がOH⁻と結合して水H₂Oになります。
そうすると、消費されたH⁺を補うように酢酸分子が電離し、H⁺が元の物質量に戻ろうとします。(このように一定に保とうとする働きを電離平衡といいます。)
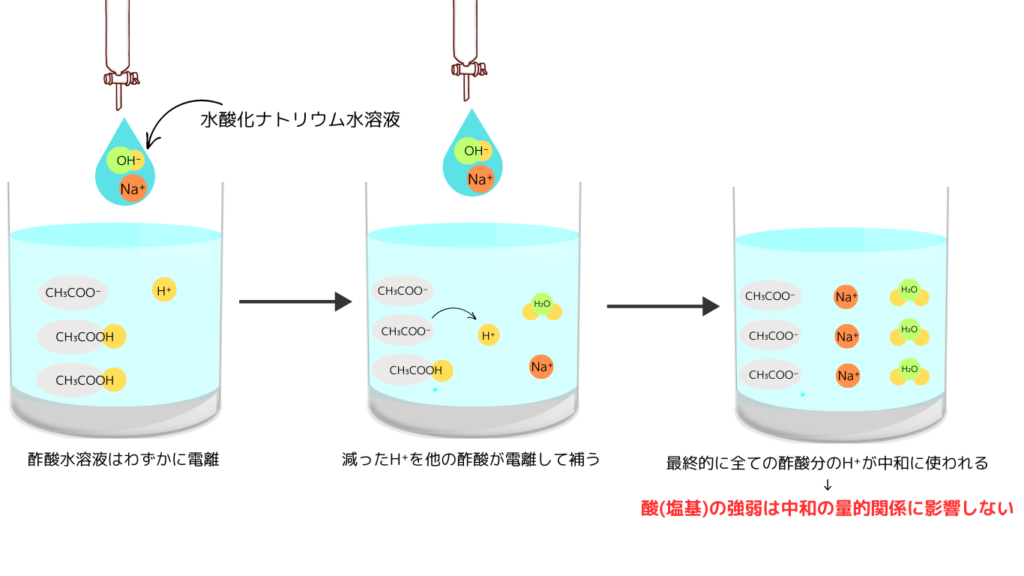
最終的には、全ての酢酸分子が電離するまで中和は続きます。これが、酸・塩基の強弱が中和と無関係な理由です。
参考:酸・塩基(アレニウスの定義・ブレンステッド・ローリーの定義・強弱・価数など)
中和の関係式
酸の価数・モル濃度・体積を使って、中和反応の量的関係を表すことが出来ます。
酸の(価数) × (濃度) × (体積) = 塩基の(価数) × (濃度) × (体積)
しかし、この関係式は酸の物質量を「モル濃度×体積」に変換しただけなので覚える必要はありません。
中和滴定
中和滴定と計算
中和の関係式を使えば、酸・塩基の濃度を中和滴定という操作で求めることができます。
中和滴定:濃度がわかっている酸(または塩基)で、濃度がわからない塩基(または酸)の濃度を中和することによって決定する操作。
完全に中和する点を中和点といい、中和点は指示薬の変化から知ることが出来ます。
また、濃度が正確に分かっている溶液を標準液と呼ぶことがあります。
問:ある濃度の希塩酸50mLを中和するのに、0.1mol/Lの水酸化ナトリウム水溶液を6.3mL要した。希塩酸の濃度は何mol/Lか。
解答:タップで表示
希塩酸の濃度をxmol/Lとすると、
1 × xmol/L × ¥(¥frac{50}{1000}¥) = 1 × 0.1mol/L × ¥(¥frac{6.3}{1000}¥)
x = 1.26×10⁻²mol/L
ガラス器具と洗浄
中和滴定で使用する実験器具は主に4つ、「メスフラスコ・コニカルビーカー・ホールピペット・ビュレット」は試験に頻出であり重要です。
これらの役割や洗浄方法についてまとめます。
| 名称 | メスフラスコ | コニカルビーカー | ホールピペット | ビュレット |
| 器具 | 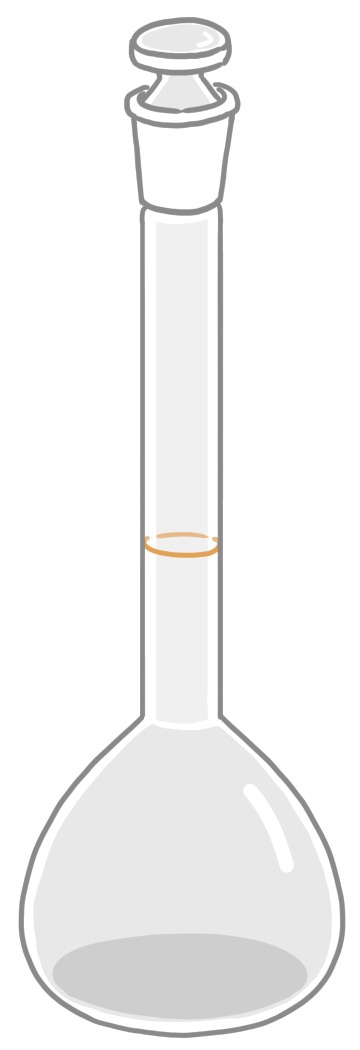 | 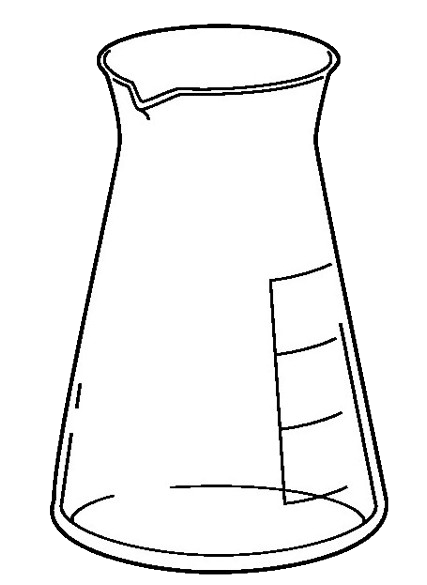 | 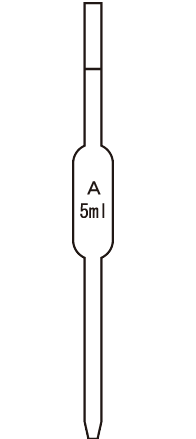 | 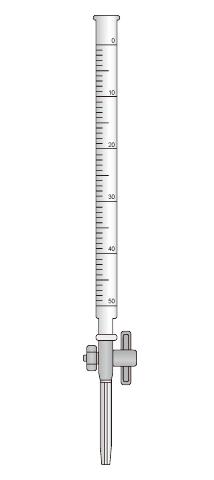 |
| 役割 | 正確な濃度の溶液をつくる。(標準液を作る、薄めるなど) | 酸と塩基を混ぜて反応させる。 | 一定量の液体を正確にはかり取る。 | 加える液体の滴下量(体積)を正確にはかり取る。 |
| 洗い方 | 純水で洗う →そのまま使用 | 純水で洗う →そのまま使用 | 純水で洗う →共洗い | 純水で洗う →共洗い |
共洗いとは、これから使う溶液で器具の中を洗浄することです。
共洗いが必要な器具は、「溶液を計量する」という役割があります。
ホールピペットやビュレットを共洗いをしないと、純水が残って溶液の濃度が薄くなります。
逆に純水で溶液を薄めるメスフラスコ、溶液を入れるだけのコニカルビーカーは純水が残っていても問題ありません。
(理屈抜きで覚えるなら、名前の最後が「ト」で終わる器具は共洗いが必要という覚え方があります。)
滴定曲線
中和滴定で、加えた酸(または塩基)の体積と混合水溶液のpHとの関係を示した曲線を滴定曲線といいます。
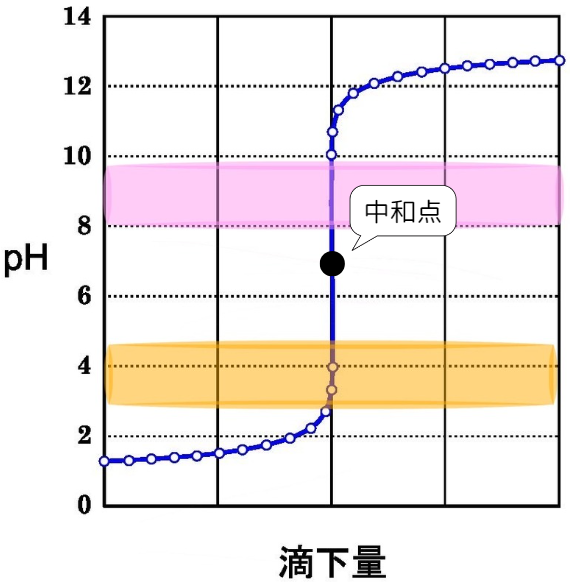
①強酸+強塩基
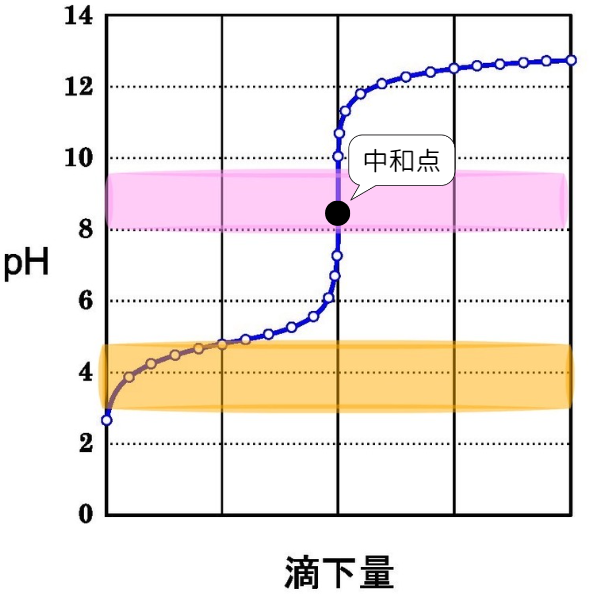
②弱酸+強塩基
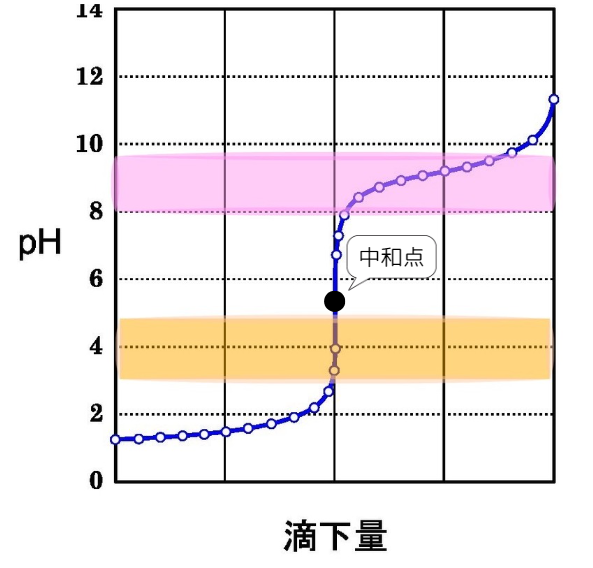
③強酸+弱塩基
(ピンクのラインがフェノールフタレインの変色域、オレンジのラインがメチルオレンジの変色域。)
参考:水素イオン濃度とpH(希釈・フェノールフタレイン・メチルオレンジ・水のイオン積など)
図のように、中和点付近でpHは急激に変化します。
そのため、中和点付近で色が変化する指示薬を使用します。
| 種類 | フェノールフタレイン | メチルオレンジ |
|---|---|---|
| 強酸+強塩基 | ◯ | ◯ |
| 弱酸+強塩基 | ◯ | ✕ |
| 強酸+弱塩基 | ✕ | ◯ |
+α
逆滴定
通常の中和滴定では扱いづらい気体の酸・塩基の濃度を決定するときは、逆滴定という間接的な操作が使われます。
「NH₃(気体)の定量を濃度がわかっているH₂SO₄とNaOH水溶液を使って求める例」を使って説明します。
①NH₃を過剰のH₂SO₄に吸収させる。
②H₂SO₄をNaOH水溶液で中和滴定する。
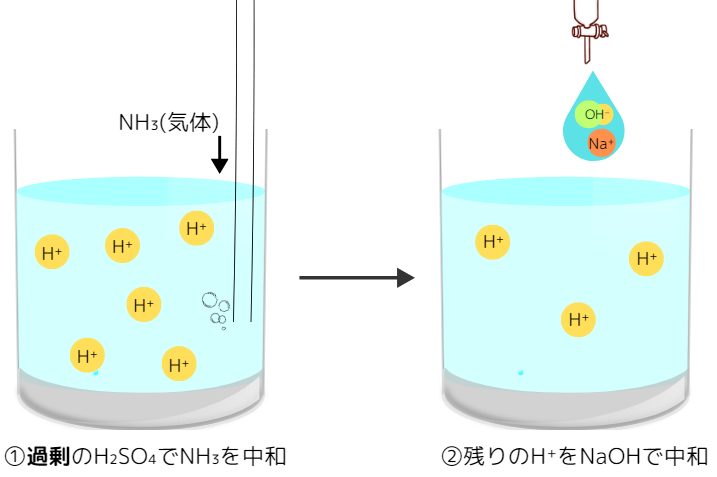
このとき、次のような関係式が成り立ちます。
(H₂SO₄のH⁺の物質量) = (NH₃が受け取るH⁺の物質量) + (NaOHのOH⁻の物質量)
このように、本来塩基は酸で滴定しますが、②のように塩基を使って逆に滴定しているため逆滴定と呼ばれます。逆のケースもあり、弱酸の気体(例えばCO₂)の定量にも逆滴定が使われます。
二段階中和
炭酸ナトリウム(水溶液は塩基性)を塩酸で中和するとき、次のように2段階の反応が進行します。
①Na₂CO₃ + HCl → NaHCO₃ + NaCl
②NaHCO₃ + HCl → H₂CO₃(H₂O + CO₂) + NaCl
このように二段階に分かれて中和が起きることを二段階中和と呼びます。
この時の滴定曲線を見てみましょう。
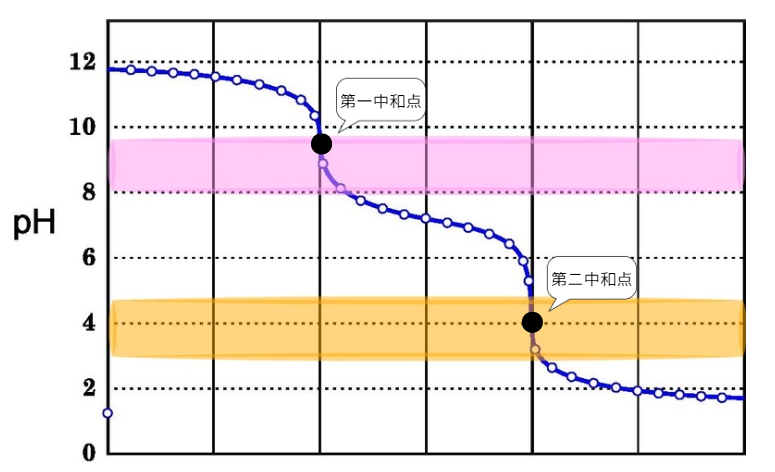
二段階中和には、中和点が2つあります。
①の反応の終了を示したのが第一中和点、②の反応の終了を示したのが第二中和点になります。


