この記事で学ぶこと
- 共有結合結晶について
- 黒鉛とダイヤモンド
- ケイ素と二酸化ケイ素
共有結合結晶
共有結合結晶とは
共有結合によって形成される結晶の中には、沢山の原子が共有結合でつながってできるものがあります。それが、共有結合結晶です。
キーワード
共有結合結晶:多数の非金属元素の原子が共有結合でつながってできる結晶
共有結合結晶の種類は少なく、高校化学で頻出なのは「黒鉛」「ダイヤモンド」「ケイ素」「二酸化ケイ素」だけです。
共有結合結晶は原子が無数に集まったものであるため、特定の分子は存在しません。
したがって黒鉛・ダイヤモンドはC、ケイ素はSi、二酸化ケイ素はSiO₂のように組成式で表します。
共有結合結晶の性質
共有結合結晶には、次の3つの性質があります。
- 結晶全体が共有結合でつながっているため極めて固く、融点が高い
- 電気を導かない(黒鉛を除く)
- 水に解けにくい
共有結合結晶の種類
ダイヤモンドと黒鉛
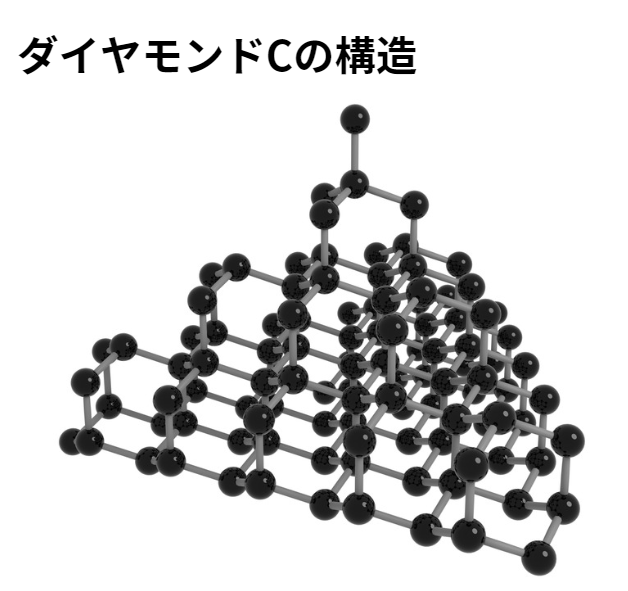
ダイヤモンドは、炭素原子の価電子を4つ全て使って他の炭素と共有結合してできる結晶です。
一方、黒鉛は価電子3つを他の炭素と共有結合することでできる結晶です。
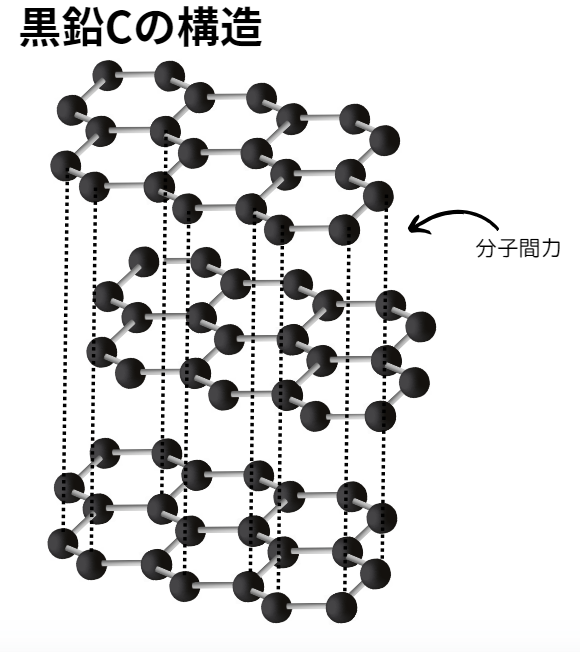
残り1つの電子は平面構造上を動いています。
また、平面構造間は分子間力がはたらいています。
ダイヤモンドと黒鉛は同じ炭素原子から成る結晶ですが、その特徴は大きく異なります。
【ダイヤモンドの特徴】
- 性質:1.きわめて硬く、融点が高い。
2.すべての価電子を共有結合に使っているため、電気を通さない。 - 色:無色透明
- 構造:立体網目状構造
【黒鉛の性質】
- 性質:1.平面同士が弱い分子間力でつながっているため、剥がれやすく柔らかい。
2.余った1つ価電子が自由に動くため、電気を通す。 - 色:黒色
- 構造:平面層状構造
ケイ素と二酸化ケイ素
単体のケイ素は、ダイヤモンドと同じ構造をもつ共有結合結晶です(炭素と同じく価電子4で同族元素のため)。
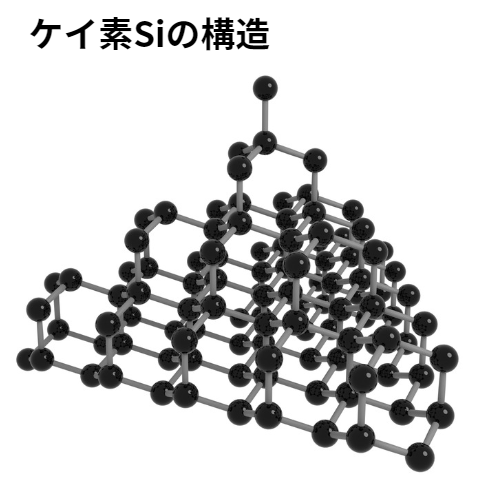
ケイ素の電気伝導性は、電気を通す導体と電気を通さない絶縁体の中間にあります。
このような物質を半導体と呼びます。
そのためケイ素は、集積回路や太陽電池などに用いられています。
二酸化ケイ素はSi-Oが繰り返されてできる共有結合結晶です。
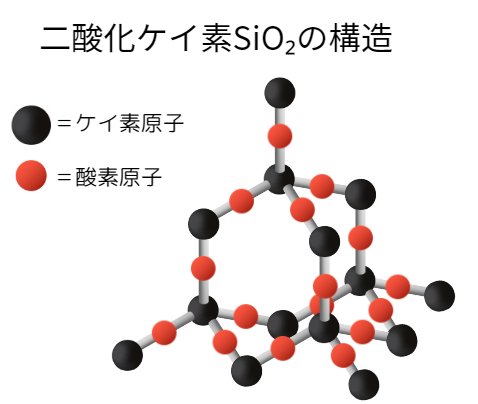
組成式がSiO₂な理由は、
酸素原子1つにつきケイ素原子が2つ結合しているためケイ素と酸素の比が、
Si:O=1:1/2×4=1:2となるからです。
二酸化ケイ素は、天然で石英や水晶として産出されます。
利用例として、窓ガラスや光ファイバーがあります。


