- 分子と共有結合
- 電子式と構造式
- 配位結合
- 高分子化合物の概要
分子
原子がより安定な構造(貴ガスの電子配置)になるための手段は2つあり、1つ目は「イオンになること」、2つ目は「分子になること」です。
この記事では「分子」について詳しく勉強します。
分子:原子が結びついてできる粒子で、共有結合によって形成される。
また、分子は分子式を用いて表されます。
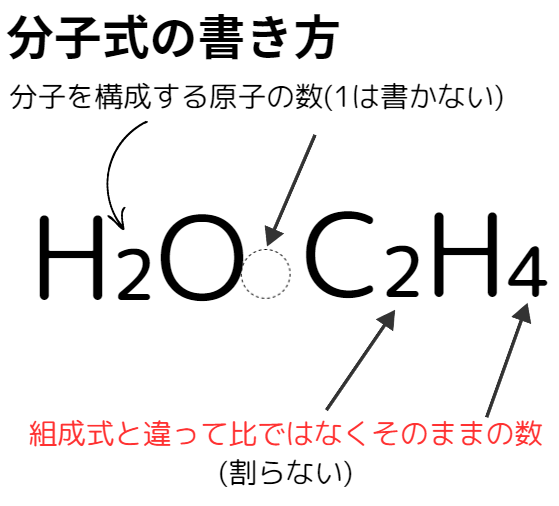
分子の成り立ち
共有結合
前述の通り、分子は共有結合という結合によって作られます。
共有結合:原子間で、それぞれの原子にある価電子を共有し合ってできる結合
例として、水素原子と塩素原子が共有結合してできる分子、塩化水素HClについて見てみましょう。
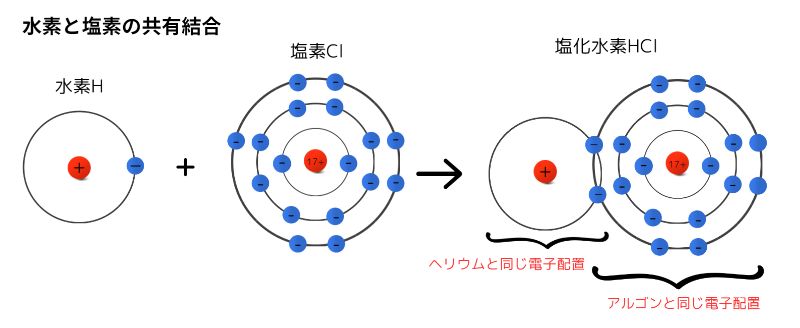
電子対とその名称
電子は、2個ずつ対を作ります。この対を電子対と呼びます。
逆に、対を作っていない1つだけの電子を不対電子と呼びます。
また、電子対には「共有電子対」と「非共有電子対」があります。
- 共有電子対:共有結合をつくっている電子対
- 非共有電子対:共有結合に関係しない、もともと対になっている電子対
先ほどの例に上がった、水素・塩素・塩化水素の電子対についてそれぞれまとめます。
| 原子・分子名 | 共有電子対数 | 非共有電子対数 | 不対電子数 |
|---|---|---|---|
| 水素H | 0 | 0 | 1 |
| 塩素Cl | 0 | 3 | 1 |
| 塩化水素HCl | 1 | 3 | 0 |
電子式・構造式
電子の様子を分かりやすく簡易的に表せる式、「電子式」があります。
電子式:最外殻電子を「・」で表し、元素記号の周りに書いた式
また、結合の様子を分かりやすく簡易的に表せる式、「構造式」があります。
構造式:原子間の1組の共有電子対を1本の線(価標)で表した式
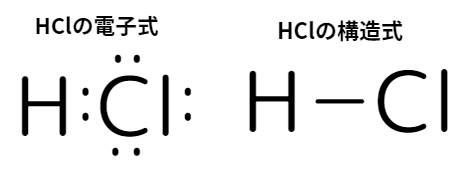
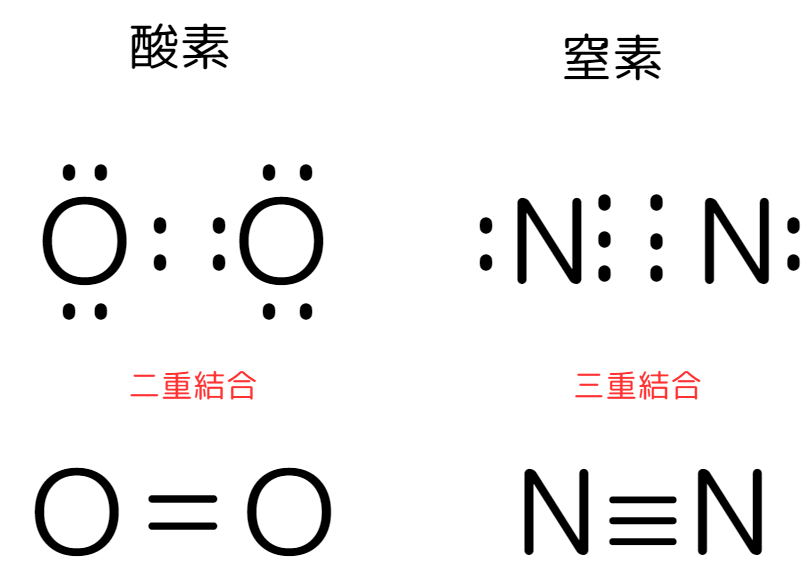
電子式・構造式で表せる共有結合は以下の3種類あります。
- 単結合:1組の共有電子対による共有結合
- 二重結合:2組の共有電子対による共有結合
- 三重結合:3組の共有電子対による共有結合
HClの結合は単結合です。
二重結合の例は酸素、三重結合の例は窒素があります。
配位結合
配位結合
共有結合の例外パターンとして、配位結合があります。
配位結合:一方が非共有電子対を供給してできる共有結合
アンモニウムイオンを例に挙げます。
アンモニアは、下記のように水素イオンと反応してアンモニウムイオンになります。
NH₃ + H⁺ → NH₄⁺
この反応は、配位結合によるものです。
電子式を用いて見てみましょう。
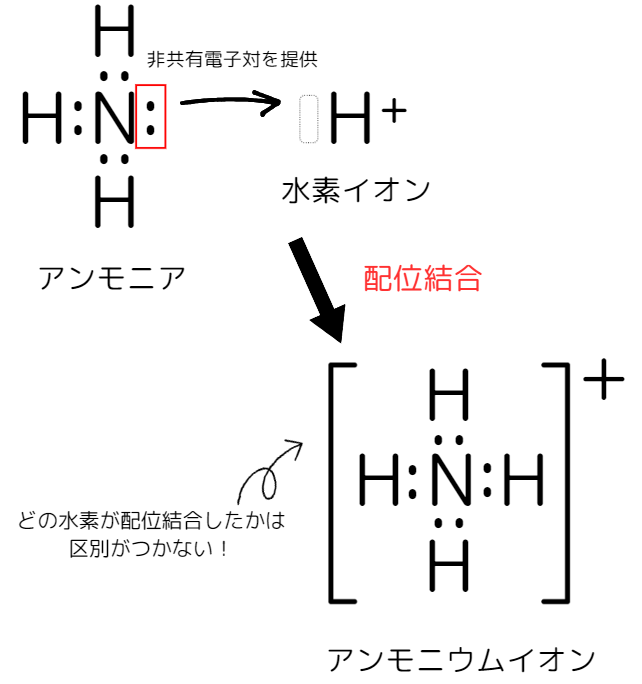
また、配位結合と共有結合は仕組みが違いますが、この2つを生成物の中で区別することはできません。
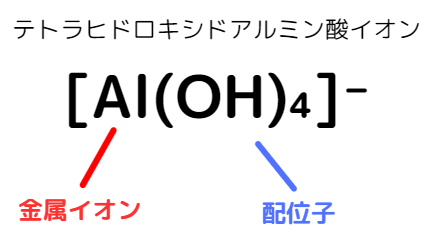
錯イオン
金属イオンに非共有電子対をもった分子や陰イオン(配位子)が配位結合してできるイオンを錯イオンと呼びます。
錯イオンに関しては、無機化学で詳しく勉強するためこの記事では以下の3つをまとめます。
・書き方
・配位子の種類
・ギリシャ数字
| 配位子 | 名称 |
|---|---|
| Cl⁻ | クロリド |
| OH⁻ | ヒドロキシド |
| CN⁻ | シアニド |
| H₂O | アクア |
| NH₃ | アンミン |
| アラビア数字 | ギリシャ数字 |
|---|---|
| 1 | モノ |
| 2 | ジ |
| 3 | トリ |
| 4 | テトラ |
| 5 | ペンタ |
| 6 | ヘキサ |
分子からなる物質
分子からなる物質には、融点・沸点が低いという性質があります。
これは、この後学習する「分子間力」が弱い力であることが理由です。
また、分子からなる物質には電解質(塩化水素・酢酸など)と非電解質(エタノールなど)があります。
教科書に様々な分子からなる物質の性質が載っていますが、このサイトでは「無機化学」で各々詳しく解説します。
高分子化合物
高分子化合物:分子量が約1万以上の化合物の総称。天然高分子化合物(デンプン・タンパク質など)と合成高分子化合物(ポリエチレン・ナイロンなど)の2つに分けられる。
高分子化合物は、1~数種類の比較的小さい分子である単量体(モノマー)が共有結合でつながって集合体である重合体(ポリマー)を作ります。
また、単量体の”つながり方”にもいくつか種類があり、高校化学では「付加重合」「縮合重合」「付加縮合」「開環重合」の4つを学びます。
この分野は、化学の「高分子化合物」で詳しく解説するので、いましばらくお待ち下さい。
(化学基礎のみであれば、上記用語と例を覚えておけば問題ないです。)


