- 電気陰性度
- 極性
- 分子間力(ファンデルワールス力・水素結合)
電気陰性度と極性
電気陰性度
原子には正に帯電した原子核が中心にあるため、周りにある電子はつねに引力を受けます。
同じように共有結合に重要な共有電子対も中心へ引き付けられます。
共有電子対が受ける力の大きさにフォーカスしたのが、電気陰性度です。
電気陰性度:原子が持つ共有電子対を引き付ける強さを示す値
電気陰性度はそれぞれの原子で決まっており、異なる原子同士が共有結合した物質(HClやH₂O)は、電気陰性度が大きい原子の方に共有電子対が偏っています。
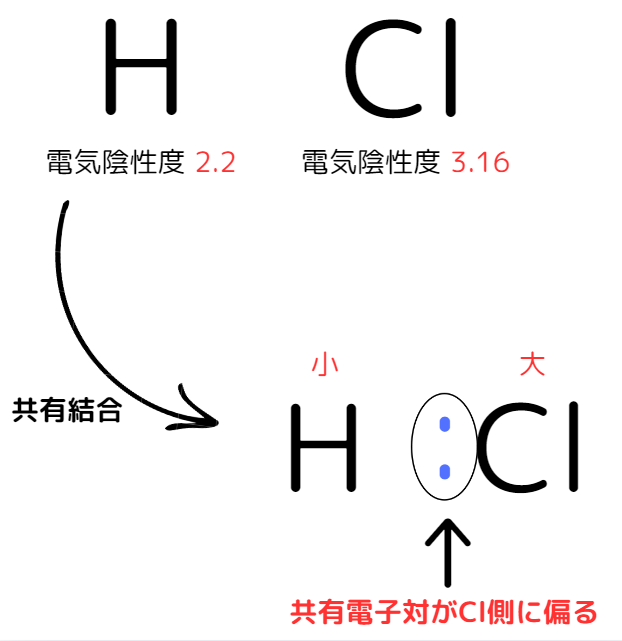
塩化水素HClを例に見てみましょう。
HClの場合、電気陰性度がH<Clのため共有電子対がCl側に偏ります。
また、周期表上での電気陰性度は次の図のようになります。
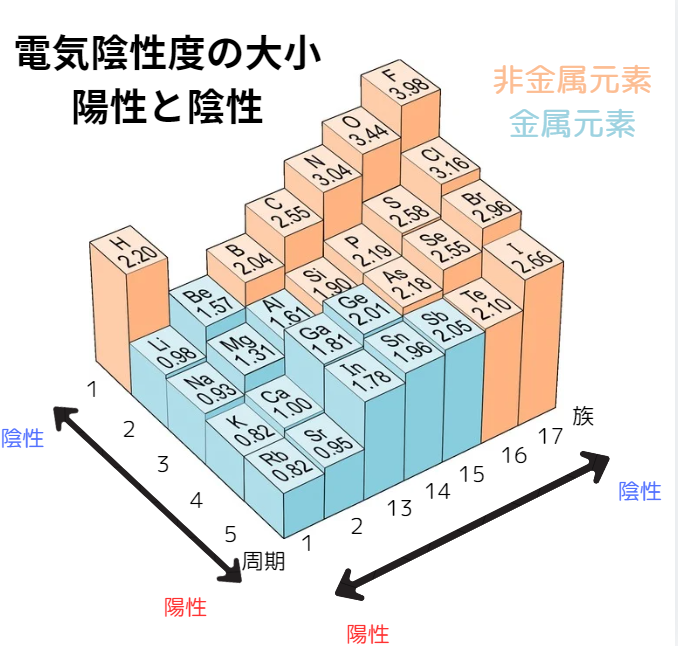
一般に、電気陰性度は周期表上で右上にある元素ほど大きいです。
ただし、貴ガス元素は共有結合をしない(共有電子対がない)ため電気陰性度は0になります。
また、電気陰性度が大きい元素は陰性が強く、電気陰性度が小さい元素は陽性が強い傾向があります。
結合の極性
電気陰性度に差があると、先ほどのHClのように共有電子対が偏り、分子内が微小な正と負の電荷に分かれます。
このことを、結合に極性があるといいます。
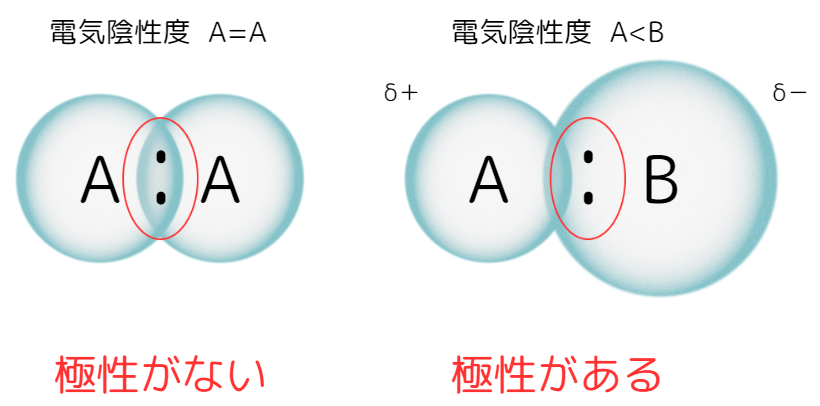
※δ(デルタ):「ごくわずか」を表す。δ+はごくわずか正の電荷がある、δ-はごくわずか付の電荷があるという意味。
分子の極性
極性のある分子を極性分子、極性のない分子を無極性分子といいます。
この場合の極性・無極性は分子全体の極性のことを指します。
下の図は、極性・無極性分子の例とその形です。
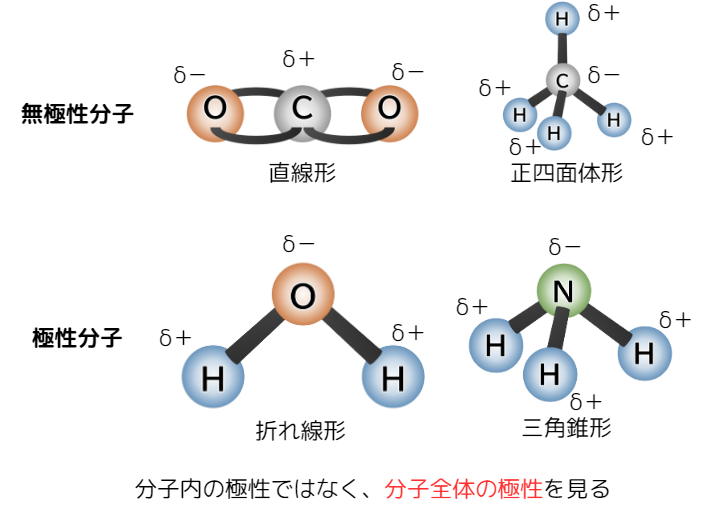
イラストにある4つの分子は、すべて分子内に極性をもちますが、
上は全体で見ると電荷を打ち消し合うため無極性分子になります。
分子間にはたらく力
分子間力
分子は共有結合によって形成されますが、分子同士は分子間力という力によって引き合っています。
分子間力:分子同士が引き合う力の総称、高校化学ではファンデルワールス力と水素結合のこと
ここからは、ファンデルワールス力と水素結合をそれぞれ見ていきましょう。
ファンデルワールス力
ファンデルワールス力は、すべての分子にはたらく引力です。
この引力の原因は、分子中の電子の動きにあります。
まず、前提として知っておいてほしいこととして、電子は原子核上を不規則に動いてます。(厳密には違いますが、高校化学ではこの考えでOKです。)
電子の位置はその瞬間によって異なるため、位置が偏ることがあります。
電子の位置の偏りから生じるのがファンデルワールス力です。
下のイラストは、水素分子を例にしたファンデルワールス力の原理図です。
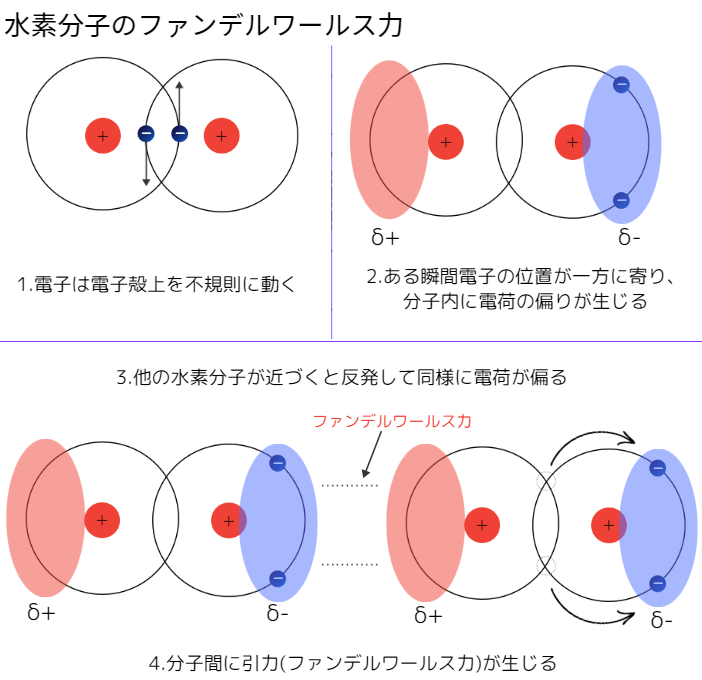
ファンデルワールス力はどんな分子にもはたらきますが、大小を決めるルールが3つあります。
- 分子量が大きいほど、ファンデルワールス力は大きい
→陽子・電子数が増えるため - 表面積が大きいほど、ファンデルワールス力は大きい
→力がはたらく場所が増えるため - 極性が大きいほど、ファンデルワールス力は大きい
→電荷の偏りが大きくなるため
原理とともに覚えておきましょう。
分子量についてはこちらで解説しています。
参考:原子量・分子量・式量(+相対質量)
水素結合
水素原子と電気陰性度の大きい原子とが結合している分子は、一般的な分子からなる物質よりも沸点・融点が高くなります。これは、水素結合と呼ばれる結合によるものです。
水素結合:窒素N・酸素O・フッ素Fの間に、水素をはさんでできる結合。(例:NH₃、H₂O、HFなど)
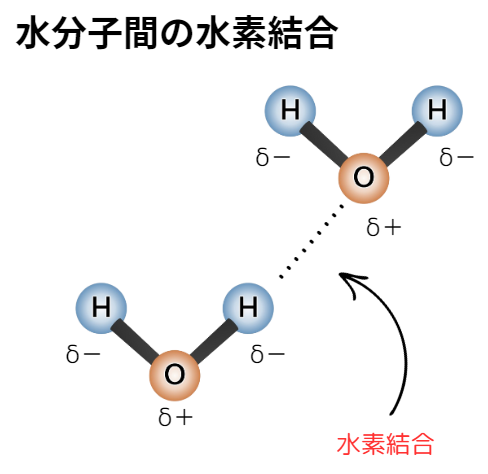
水分子H₂O間の水素結合を見てみましょう。
下図のように、水分子中の水素原子と、他の水分子中の酸素原子とが水素結合を作っています。
(実際は、1つの水分子は他4つの水分子と水素結合をしています。)
ファンデルワールス力と比べて電荷の偏りが大きいため、水素結合は、ファンデルワールス力よりも非常に強いです。
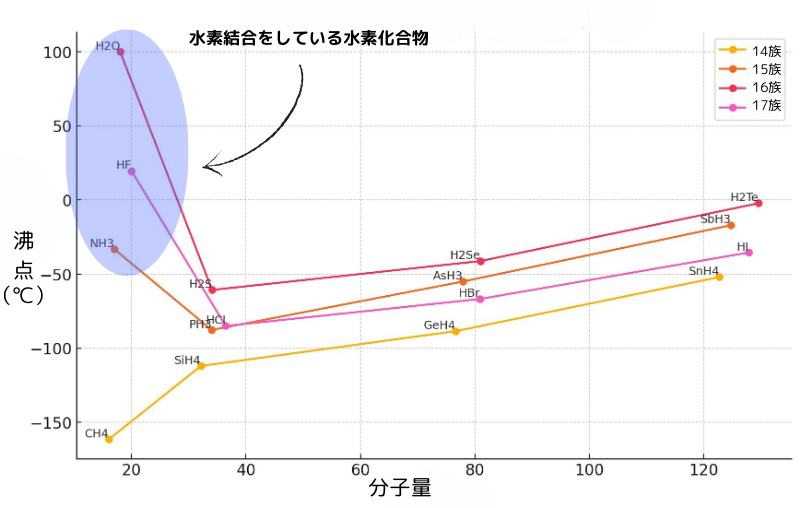
下のグラフを見ると、水素結合している物質が特別沸点が高い事が分かります。
また、分子量が増えると、沸点が上がっていることも分かります。
分子結晶
分子からなる物質の結晶を分子結晶と呼びます。
分子結晶の特徴
- 分子間力が弱いため、融点が低い
- 無極性分子からなる分子結晶は、昇華性を持つものがある…例:二酸化炭素・ナフタレン・ヨウ素など
- 電気を導かない
氷(水)の構造
分子からなる水H₂Oは、他の物質からは見られない特異な性質を持ちます。
一般的に、物質は固体→液体→気体になるにつれて密度が小さくなっていきます。
しかし、H₂Oの密度は固体(氷)<液体(水)です。

その原因は、氷の構造にあります。
下のイラストは、氷と水の分子構造です。
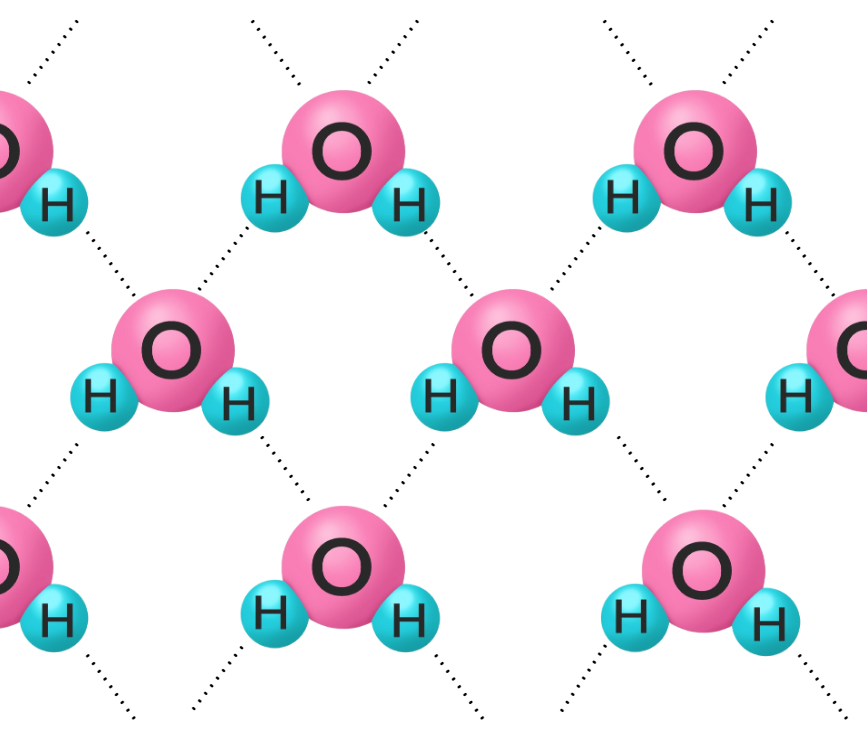
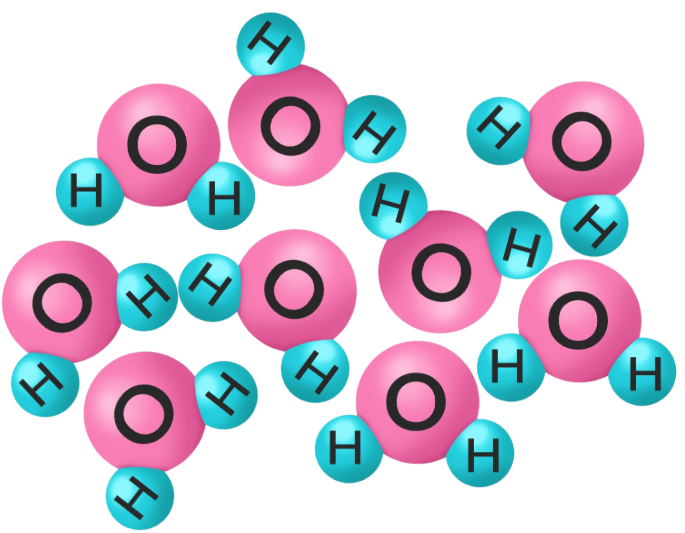
水は不規則に分子が集まっているのに対して、氷は分子が規則正しく配列し、隙間が多くなります。
そのため、同じ分子の数に対して氷の方が体積が大きい=密度が小さくなります。


