- 原子の構造(陽子・電子・中性子など)
- 同位体
- 電子配置
- 電子軌道(+α)
原子の構造
原子を構成する粒子
物質を構成する粒子を、これから細かく学んでいきます。
まずは、原子です。
原子は、物質を構成する非常に小さな粒子(直径約10^-10mほど)ですが、原子は3種類の粒子から作られています。それが、陽子・中性子・電子です。
下の図は、ヘリウム(He:原子番号2番)の構造です。
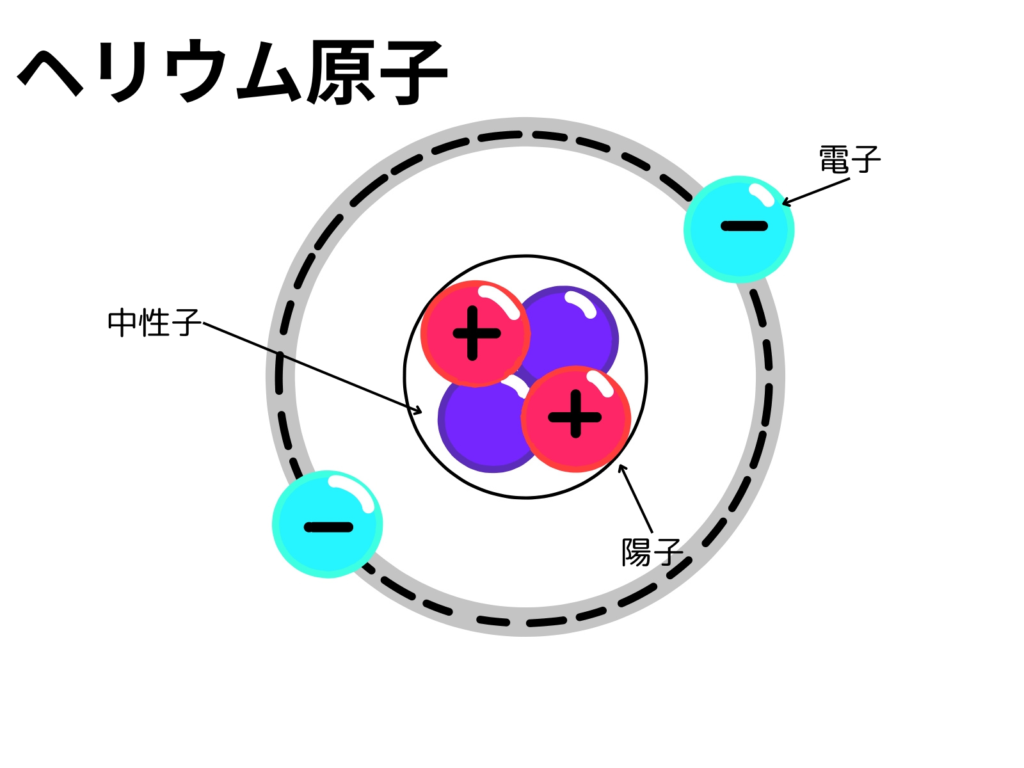
原子は、陽子と中性子が中心に固まり周りを電子が取り巻く構造をしています。
また、陽子と中性子をまとめて、原子核と呼びます。
陽子・電子・中性子の数を表すもの
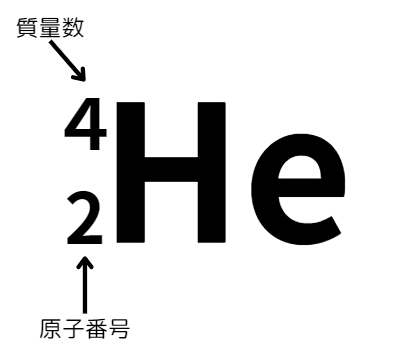
陽子・電子・中性子を数を表すものに、原子番号と質量数があります。
- 原子番号:原子核中の陽子の数
- 質量数:原子核中の陽子と中性子の数
原子の種類を表すときは、次のような表記法を使います。
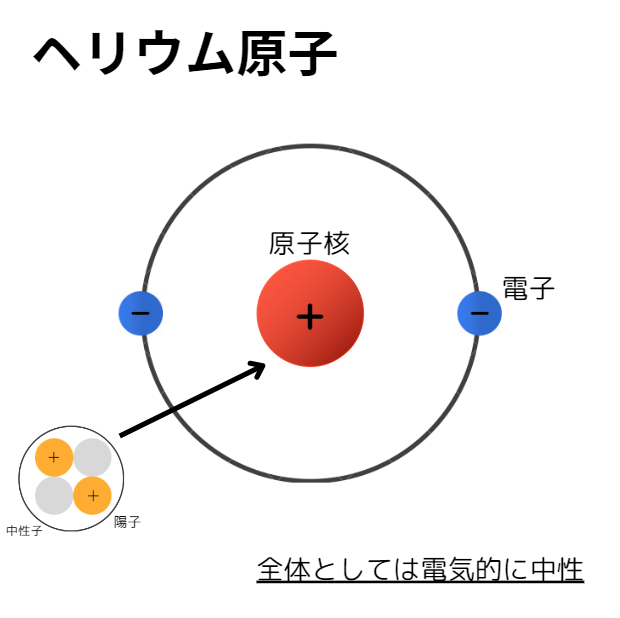
粒子の電荷
電荷:物質や粒子がもつ電気の量、正と負がある
陽子は正、電子は負の電気を持っており、中性子は電気を持っていません。陽子と電子の電荷の絶対値は等しいため、原子全体としては電気的に中性となります。
同位体
同位体
先ほど勉強したように、元素の種類を決定するのは陽子です。陽子の数が異なれば、それらは他の種類の元素となります。では、陽子の数が同じで中性子の数が異なる場合はどうなるでしょう。そこで考えるのが同位体です。
同位体:同じ元素の原子で、中性子数が異なる原子同士のこと
例えば、水素の同位体には中性子数0のもの(1H:軽水素)、、1のもの(2H:重水素)、2のもの(3H:三重水素)があります。
多くの元素は、何種類かの同位体がほぼ一定の割合で存在しています。
放射性同位体と放射線
同位体の中には原子核が不安定のものがあり、安定なものへと変化しようとします。この変化の際に放射線を放出する同位体を放射性同位体と呼びます。
また、放射線の種類にはα線(ヘリウム原子核)、β線(電子)、γ線(電磁波)などがあります。
電子配置
次は、電子に着目していきます。電子は物質の性質に関わる重要な粒子です。
電子殻と電子配置
電子は、原子核の周りにある電子殻と呼ばれる層に存在しています。
電子殻は内側からK殻・L殻・M殻・N殻…のように続いており、電子は内側の電子殻から入ります。
また、K殻をn=1・L殻をn=2のように決めていくと、電子殻に入ることができる電子は2n²個になります。
| 名称 | K殻 | L殻 | M殻 | N殻 | … |
| n | 1 | 2 | 3 | 4 | … |
| 電子の最大数 | 2 | 8 | 18 | 32 | … |
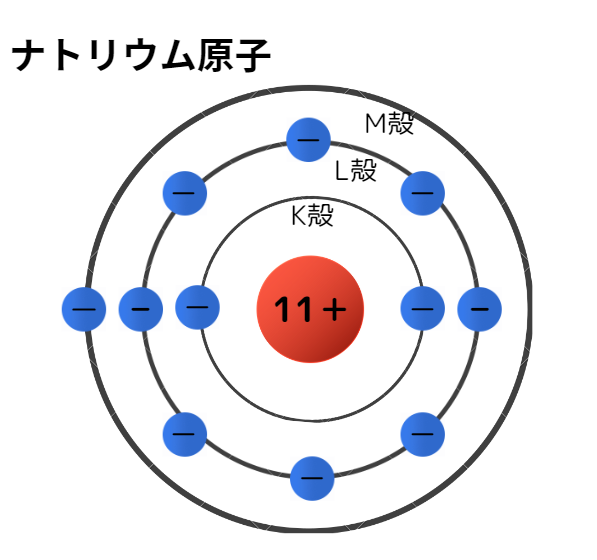
例えばナトリウム原子は、下図のようにK殻に2つ、L殻に8つ、M殻に1つ電子が収容されます。
このような電子殻への電子の入り方を電子配置と呼びます。
価電子と貴ガス
物質の化学的性質を決める要素の1つが、価電子です。
価電子:最外殻にある1~7の電子。最外殻電子が最大数の電子(閉殻)、または8個の場合価電子は0になる
例えば、ナトリウムの価電子は最外殻(M殻)の電子が1つなので、価電子は1です。
また、ネオン(Ne:原子番号10番)は最外殻(L殻)の電子が8つなので、価電子は0です。
価電子の数が同じ原子どうしは、化学的性質が似ています。
その中でも、価電子数が0の原子(He,Ne,Arなど)を貴ガスと呼びます。貴ガスは反応性に乏しいことから不活性ガスとも呼ばれます。
+α
放射性同位体の利用
放射性同位体が崩壊してもとの半分の量になる時間を半減期といいます。
半減期を利用すると、生物の遺骸や遺物の年代測定をすることができます。具体的には、放射性同位体である¹⁴Cを用いた方法があります。
生物の遺骸・遺物に残っている¹⁴Cの存在比と半減期を考えることで、どのくらい前のものかを測定できます。
電子軌道
同心円で平面に表した電子配置(上で使っていた模式図)をボーアモデルと呼びます。しかし、実際電子はこのように収容されているわけでなく、電子軌道と呼ばれる電子が存在する確率が高い領域に収容されています。
電子軌道には名前がついており、例えばK殻は球の形をしている1s軌道、L殻は球形の2S軌道と3つの亜鈴状の2p軌道からなっています。
各軌道に電子は2個ずつ(アップスピンとダウンスピン)入ります。
電子はエネルギーが低い軌道がら入っていき、小さい順から
1s→2s→2p→3s→3p→4s→3d…と入っていきます。カリウム以降の元素の電子がM殻ではなくN殻に収容されるのは、エネルギーが4s軌道<3d軌道であるからです。
(詳細は、教科書p237を参照してください。)



コメント