- 周期表の概要
- 元素の分類
- 族の分類
- 周期表で見るイオン化エネルギー・電子親和力(+α)
- 原子・イオンの大きさ(+α)
元素の周期律と周期表
元素を原子番号の順に並べ、性質の似た元素を同じ縦の列に並べた表を周期表と呼びます。
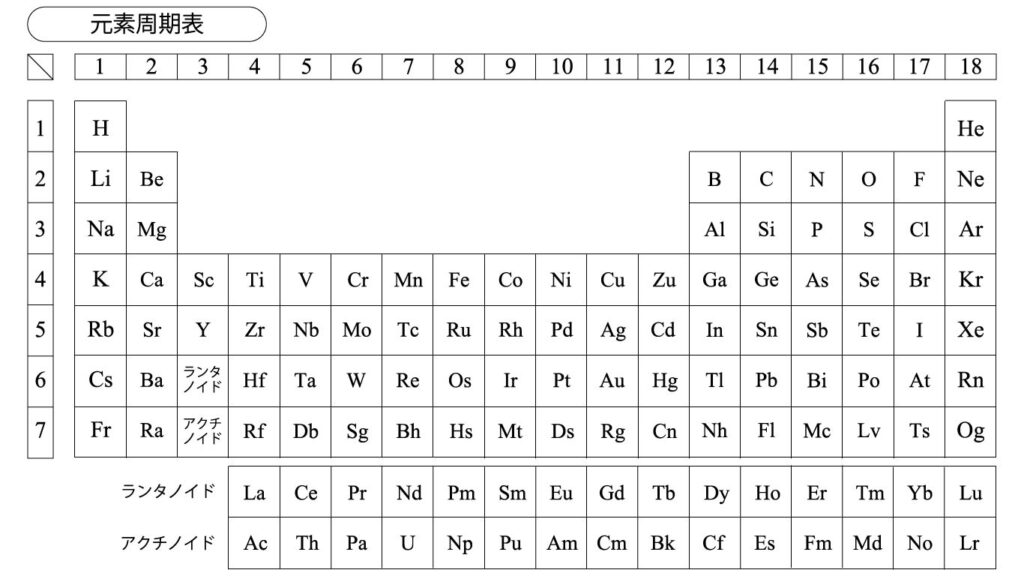
周期表は、縦の族・横の周期で構成されています。
- 族:縦の列で似たような性質の元素が並んでいる。最外殻電子の数が等しい(例:1族なら1つ、17族なら7つ)。
- 周期:横の列で最外殻が等しい(例:1周期ならK殻、2周期ならL殻)
このように、元素の性質が周期性を示すことを周期律と呼びます。
元素の分類
元素の分け方は大きく分けて2つあります。
- 典型元素と遷移元素
- 金属元素と非金属元素
典型元素と遷移元素
周期表の1・2族と13~18族の元素を典型元素、3~12族の元素を遷移元素と呼びます。

【典型元素の特徴】
・族の1の位の数と最外殻電子の数が等しい(1族なら1個、13族なら3個)
・縦の列(同じ族)に並んだ元素同士は性質が似ている
【遷移元素の特徴】
・最外殻電子の数は1個か2個
・横の行(同じ周期)に並んだ元素同士は性質が似ている
金属元素と非金属元素
水素を除く左側にある元素を金属元素、右側にある元素を非金属元素と呼びます。
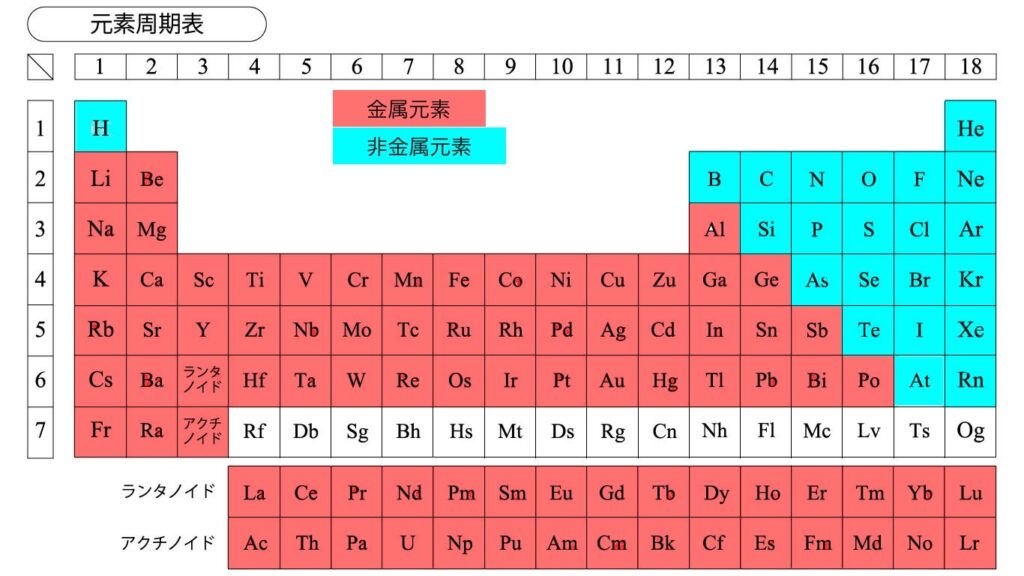
【金属元素の特徴】
・陽性が強く、陽イオンになりやすい
【非金属元素】
・陰性が強く、陰イオンになりやすい
・水素は陽イオンになりやすい
・全て典型元素である
同族元素
同じ族の元素(同族元素)はそれぞれ性質が似ており、一部には名前もついています。
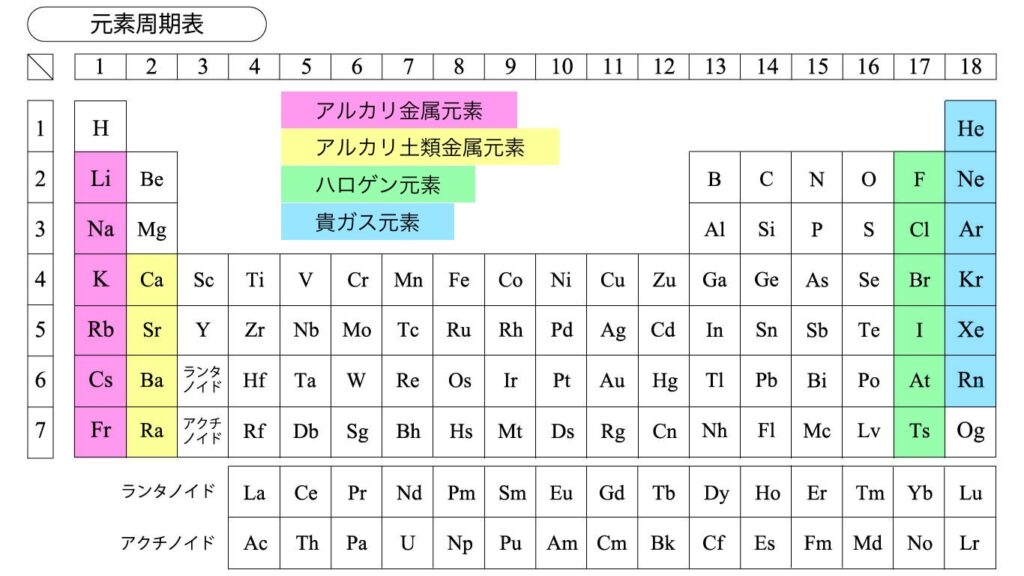
以下の4つを見ていきましょう。
- アルカリ金属元素
- アルカリ土類金属元素
- ハロゲン元素
- 貴ガス元素
アルカリ金属元素
水素を除く1族の元素をアルカリ金属元素と呼びます。
【アルカリ金属元素の性質】
・単体は、密度が小さい・融点が低い・やわらかい
・常温の水と反応して水素を発生する
・空気中の酸素や水蒸気と反応する→灯油中に保存する
・化合物は炎色反応を示す
アルカリ土類金属元素
ベリリウムBe、マグネシウムMgを除く2族の元素をアルカリ土類金属元素と呼びます。
【アルカリ土類金属元素の性質】
・アルカリ金属元素よりも密度が大きく、融点が高い
・常温の水と反応して水素を発生する
・化合物は炎色反応を示す
ハロゲン元素
17族の元素をハロゲン元素と呼びます。
【ハロゲン元素の性質】
・単体は2原子分子
・有色で毒性がある
・電子を奪う力(酸化力)が強い
貴ガス元素
18族の元素を貴ガス元素と呼びます。
【貴ガス元素の性質】
・単体は単原子分子
・閉殻であるため反応性に乏しい
・沸点が非常に低い→常温で気体
・無色無臭
+α
イオン化エネルギー・電子親和力の周期律
イオン化エネルギー・電子親和力は、同族元素において大きさが似ています。
水素~カルシウムまでのグラフをそれぞれ見ていきましょう。
【イオン化エネルギー】
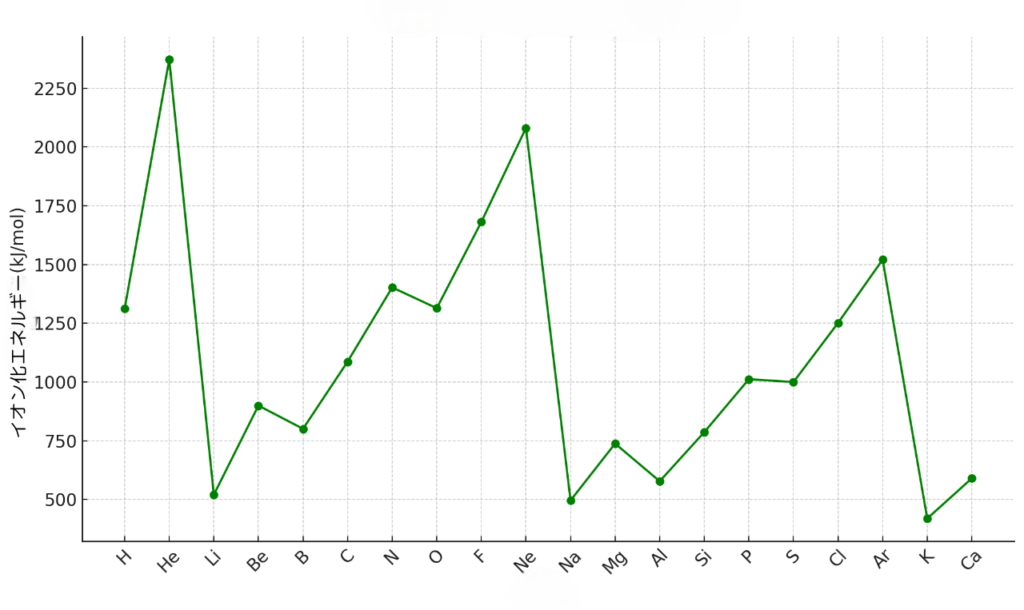
イオン化エネルギーは周期表の右・上にある元素ほど大きい傾向があります。
・右の方が大きい理由:原子核中の陽子数(+)が増えるため引力が大きくなり、電子1つを取るために必要なエネルギーが大きくなるから
・上の方が大きい理由:上の元素の方が電子殻が原子核の近くにあり引力が大きいため、電子1つを取るために必要なエネルギーが大きくなるから
したがって、上図のような周期律が見られます。
【電子親和力】
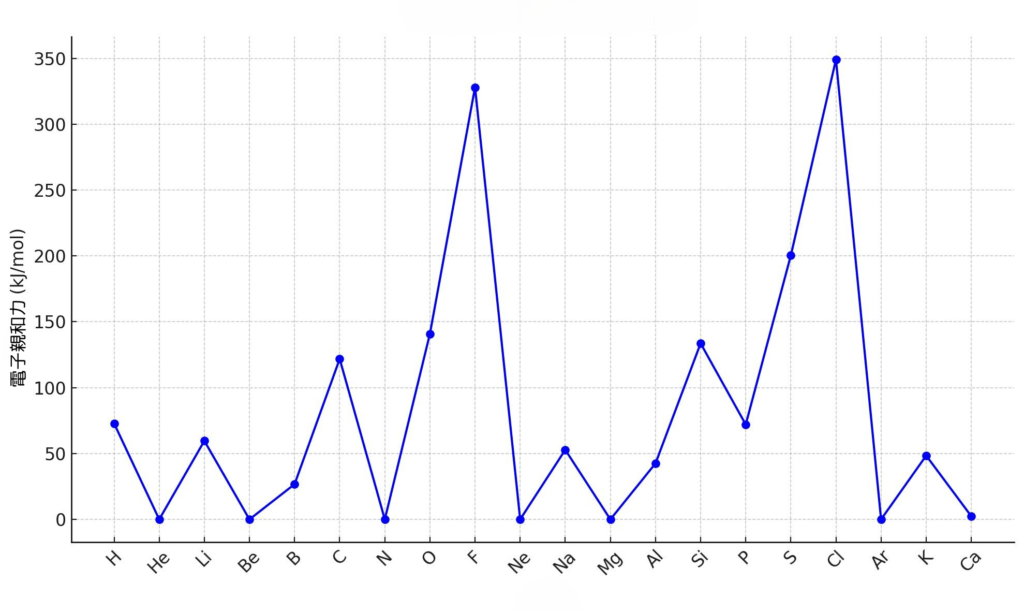
電子親和力は、イオン化エネルギーほどはっきりした傾向はないものの、右上の元素ほど大きいと言えます。ハロゲン元素が大きい値を取っていますね。
なお、電子親和力がまばらなのは電子の相互作用が関係するため、大学の内容となります。
原子・イオンの大きさ
原子とイオンの大きさには、規則性があります。
【原子の大きさの規則性】
1.同族元素では、下に行くほど原子は大きい
2.同周期元素では、右に行くほど原子は小さい【それぞれの理由】
【その理由】
1.下に行くほど大きい電子殻を持つから
2.右に行くほど陽子数が増え、引力が増して縮むから
【イオンの大きさの規則性】
1.原子が陽イオンになると、小さくなる
2.原子が陰イオンになると、大きくなる
3.同じ電子配置のイオンでは、原子番号が大きいほど小さい
【その理由】
1.最外電子殻が、もとの原子の1つ前になり小さくなるから(例:Naの最外電子殻はM殻、 Na⁺の最外電子殻はL殻)
2.電子数が増え、電子の反発力が増すから
3.原子番号が大きいほど陽子数が増え、引力が増して縮むから


