- 水素イオン濃度
- pHについて
- 希釈とpH
- pH指示薬と測定
水素イオン濃度
準備 モル濃度の表記
化学では、化学式を[]で囲んだものはモル濃度を表します。
例えば、この後に出てくる[H⁺]は水素イオンのモル濃度(水素イオン濃度)を表します。
参考:溶液の濃度(溶解・質量パーセント濃度・モル濃度など)
水の電離
純水H₂Oは、わずかですが次のように電離しています。
H₂O ⇄ H⁺ + OH⁻
ただし、純水は中性なので水素イオンと水酸化物イオンのモル濃度(物質量)は等しいです。
具体的には、25℃における水素イオン濃度[H⁺]と水酸化物イオン濃度[OH⁻]は1.0×10⁻⁷mol/Lになります。
[H⁺] = [OH⁻] = 1.0×10⁻⁷mol/L (25℃)
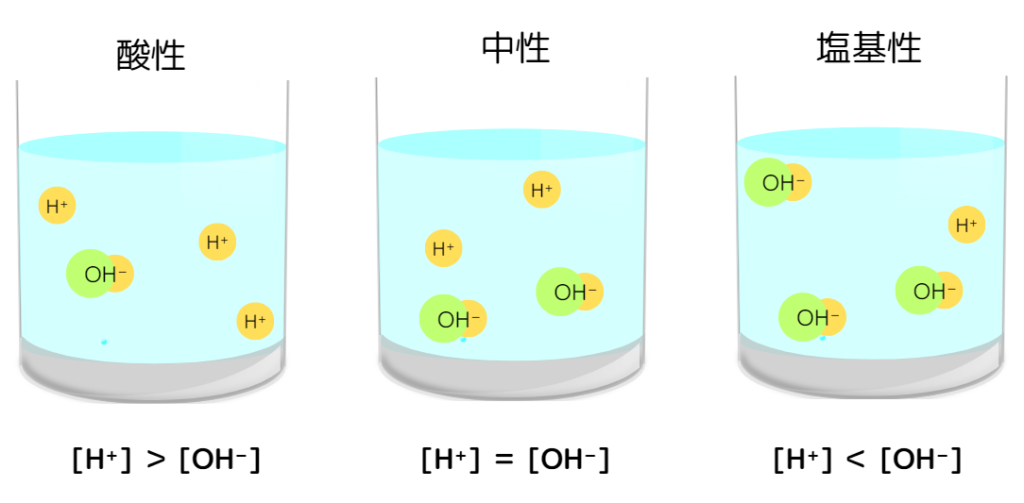
水素イオン濃度と水溶液の性質
水溶液の性質が酸性・中性・塩基性と決まるのは、水素イオン濃度[H⁺]と水酸化物イオン濃度[OH⁻]の大小によります。
酸性 :[H⁺] > [OH⁻]
中性 :[H⁺] = [OH⁻]
塩基性:[H⁺] < [OH⁻]
水素イオン濃度の求め方
水素イオン濃度を具体例を使って求めていきましょう。
問:0.10mol/Lの酢酸(電離度0.02)では、[H⁺]は何mol/Lか。
【解答・解説】
まずは酢酸の電離を式で表しましょう。
CH₃COOH ⇄ CH₃COO⁻ + H⁺
[H⁺]を知るためには、酢酸に対して水素イオンがどのくらい存在するかを知らなければなりません。そこで使うのが、前回学習した電離度です。
もとの酢酸の濃度に電離度をかけたものが、[H⁺]そのものになります。
したがって、次のようになります。
[H⁺] = 0.10mol/L × 0.02 = 2.0×10⁻³mol/L
以上の求め方を一般化してみます。
c(mol/L)である一価の酸HAは次のように電離する HA → H⁺ + A⁻
このとき、HAの電離度をαとすると[H⁺]は次のように表せる。
[H⁺] = cα(mol/L)
同様にして、c′(mol/L)である一価の塩基の[OH⁻]は、電離度をα′とすると次のように表せる。
[OH⁻] = c′α′(mol/L)
pH
【発展】水のイオン積
発展(化学)の内容になりますが、次の説明の際に必要なため水のイオン積について説明します。
水のイオン積:[H⁺]と[OH⁻]の積Kwのこと。Kwは温度が一定ならば一定の値をとる。
特に、25℃における水のイオン積は次のようになります。
Kw = [H⁺][OH⁻] = 1.0×10⁻¹⁴ mol²/L²
先ほど挙げた25℃純水の水のイオン積Kwを求めてみると、上記値と一致する事がわかります。
純水のKw = 1.0×10⁻⁷mol/L × 1.0×10⁻⁷mol/L = 1.0×10⁻¹⁴ mol²/L²
水素イオン濃度とpH
水のイオン積の関係を使うと、[H⁺]と[OH⁻]が反比例の関係にあることが分かります。
[H⁺][OH⁻] = Kw
[H⁺]= \(\frac{Kw}{[OH⁻] }\) (反比例)
つまり、温度一定ならば水溶液の性質(酸性・中性・塩基性)は、水素イオン濃度[H⁺]のみで表すことが出来ます。
しかし、水素イオン濃度の値は非常に小さく、ばらつきも多いため使いづらいです。
そこで、[H⁺]を扱いやすくしたのが、pH(水素イオン指数)です。
pH(水素イオン指数):[H⁺]=1.0×10⁻ⁿとしたときのnの値。n=0~14
例えば、[H⁺]=1.0×10⁻³mol/LのときpH=3,[H⁺]=1.0×10⁻¹²mol/LのときpH=12のようになります。
(pH本来の定義は -log₁₀[H⁺] ですが「化学で学ぶ」「対数を扱う」ためこの記事では解説を省略させていただきます。)
pHと水溶液の性質
25℃における中性の水溶液は、[H⁺] = [OH⁻] = 1.0×10⁻⁷mol/LなのでpH=7です。
次に酸性・塩基性のpHについても見ていきましょう。
酸性は中性よりも水素イオンが多いため、[H⁺]が大きくなる=pHが7より小さくなる
塩基性は逆に中性よりも水素イオンが少ないため、[H⁺]が小さくなる=pHが7より大きくなるという関係になります。
酸性 :pH < 7
中性 :pH = 7
塩基性:pH > 7
水溶液の希釈とpH
希釈とは、溶液に溶媒を加えて薄める(濃度を小さくする)ことです。
酸性・塩基性の水溶液を希釈すると、pH7(中性)に近づきます。また、10倍に希釈する毎にpHは1変化します。
具体的には、pH=1の酸性水溶液を10倍に希釈するとpH=2に、100倍に希釈するとpH=3になります。
なお、希釈によって酸性→塩基性、または塩基性→酸性になることはありません。
これは、希釈していくほどの電離H₂O ⇄ H⁺ + OH⁻の影響が大きくなるためです。
pHを求める計算問題
問1:25℃で、次の水溶液のpHを求めよ。必要であれば次の関係式を用いても良い。
[H⁺]= \(\frac{1.0×10⁻¹⁴mol²/L²}{[OH⁻] }\)
(1)0.5mol/Lの酢酸水溶液(電離度0.02)
(2)0.1mol/Lの水酸化ナトリウム水溶液(電離度1.0)
(3)0.05mol/Lの希硫酸(電離度1.0)
解答:タップで表示
(1)
酢酸は1価の酸であるから、
酢酸水溶液の[H⁺] = 0.5mol/L × 0.02 = 1.0×10⁻²mol/L
よって、PH=2
(2)
水酸化ナトリウムは1価の塩基であるから、
水酸化ナトリウムの[OH⁻] = 0.1mol/L × 1.0 = 0.1mol/L
関係式から、[H⁺] = \(\frac{1.0×10⁻¹⁴mol²/L²}{[0.1] }\)=1.0×10⁻¹³mol/L
よって、pH=13
(3)
希硫酸は2価の酸(H₂SO₄ → 2H⁺ + SO₄²⁻)であるから、
硫酸の[H⁺] = 0.05 × 1.0 × 2(価数) = 1.0×10⁻¹mol/L
よって、pH=1
問2:pH=12の水酸化ナトリウム水溶液を100倍に希釈した水溶液のpHはいくらか。
解答:タップで表示
塩基性の水溶液を100倍に希釈するため、水素イオンが増加し水酸化物イオンが減少する。
10倍でpHが1変わるから、
pH=12-2=10
pH指示薬とpHの測定
pH指示薬
pHによって色が変化する物質(pH指示薬)を使えば、反応によるpHの変化を視覚的に確認することができます。
この記事では、高校化学で頻出のメチルオレンジとフェノールフタレインについて説明します。
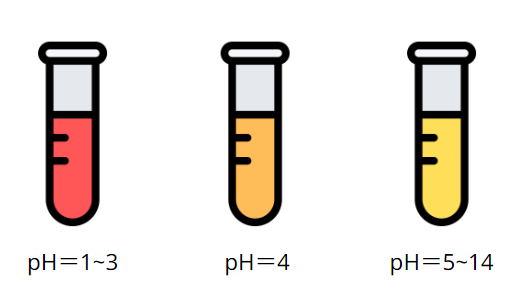
メチルオレンジ
約pH3.1〜pH4.4に変色域(色が変わるpHの範囲)を持ちます。
色は酸性側で赤、塩基性側で黄色です。
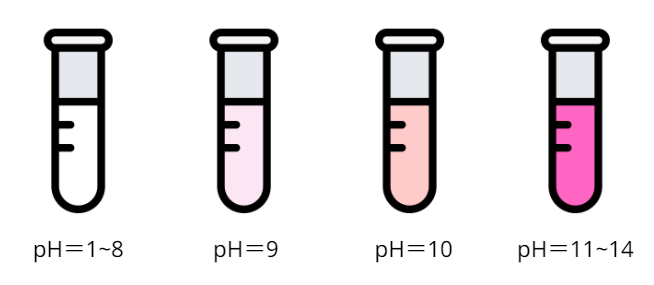
フェノールフタレイン
約pH8.3〜pH10に変色域(色が変わるpHの範囲)を持ちます。
色は酸性側で無色、塩基性側で赤色です。
pHの測定
水溶液のpHを測定する時に、pH試験紙やpH計などが用いられますが試験に出ることはありません。
軽く知っておく程度でOKです。


