- ワルダー法・ウィンクラー法の手順と原理
- 計算問題の解き方
混合塩基の定量
この記事では、「NaOHとNa₂CO₃の混合溶液の各量(主に物質量)」を求める2種類の方法、「ワルダー法」と「ウィンクラー法」を解説します。
特にワルダー法は名前こそ聞き覚えがないかも知れませんが、入試に頻出なため理解しておきましょう。
定量に必要な知識
ワルダー法・ウィンクラー法に入る前に、「NaOHとNa₂CO₃の混合溶液」をHClで中和するときの反応を知っておきましょう。
HClが滴下されるにつれて、次の反応が順番に起こります。
①NaOH + HCl → NaCl + H₂O
②Na₂CO₃ + HCl → NaHCO₃ + NaCl
③NaHCO₃ + HCl → NaCl + H₂CO₃
「強塩基であるNaOHの中和→Na₂CO₃の一段階目の中和→Na₂CO₃の二段階目の中和」の順です。
ワルダー法
ワルダー法の手順と原理
ワルダー法は、次の手順で定量していきます。
- 混合溶液にフェノールフタレインを指示薬として加える
- HClを滴下して、第一中和点まで中和する→NaOHとNa₂CO₃の物質量の和を定量
- 混合溶液にメチルオレンジを指示薬として加える
- 更にHClを滴下して、第二中和点まで中和する→Na₂CO₃の物質量を定量
順に見ていきましょう。
フェノールフタレインを加える
混合溶液はNaOHとNa₂CO₃からなるため、塩基性を示します。
そこでフェノールフタレインを加えるとNa₂CO₃の第一中和点はpH≒8.5なので、1段階目の中和の終了をフェノールフタレインの赤色→無色の変化で知ることが出来ます。
(フェノールフタレインの変色域:pH=8.3~10)
二段階中和はこちらの記事の最後で紹介しています
→中和滴定(量的関係・滴定曲線・ガラス器具・逆滴定・二段階中和など)
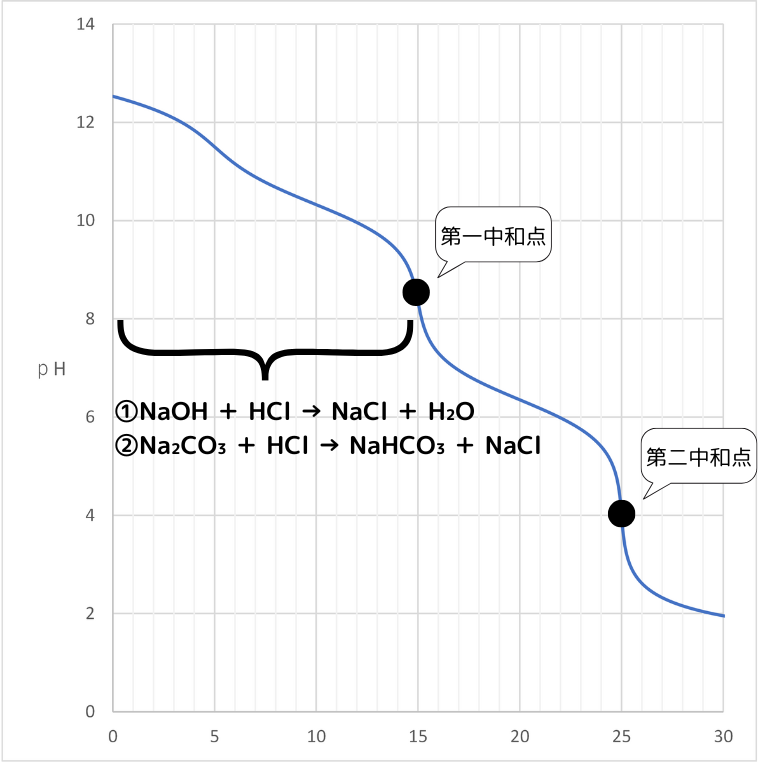
第一中和点まで滴定
この手順で、NaOHとNa₂CO₃の物質量の和を求めることが出来ます。
第一中和点までHClで中和します。このとき、次の反応が起こります。
①NaOH + HCl → NaCl + H₂O
②Na₂CO₃ + HCl → NaHCO₃ + NaCl
NaOHが完全に中和され、Na₂CO₃の1段階目の中和が完了しています。
Na₂CO₃の物質量:第一中和点までに受け取るH⁺=1:1なので、ここまで滴下したHClの物質量とNaOH・Na₂CO₃の物質量の間に次の関係が成り立ちます。
第一中和点まで滴下したHClの物質量 = NaOHの物質量 + Na₂CO₃の物質量
メチルオレンジを加える
第一中和点に達すると、フェノールフタレインは無色となります。
そこでメチルオレンジを加えるとNa₂CO₃の第二中和点はpH≒4.0なので、2段階目の中和の終了をメチルオレンジの黄色→赤色の変化で知ることが出来ます。
(メチルオレンジの変色域:pH=3.1~4.4)
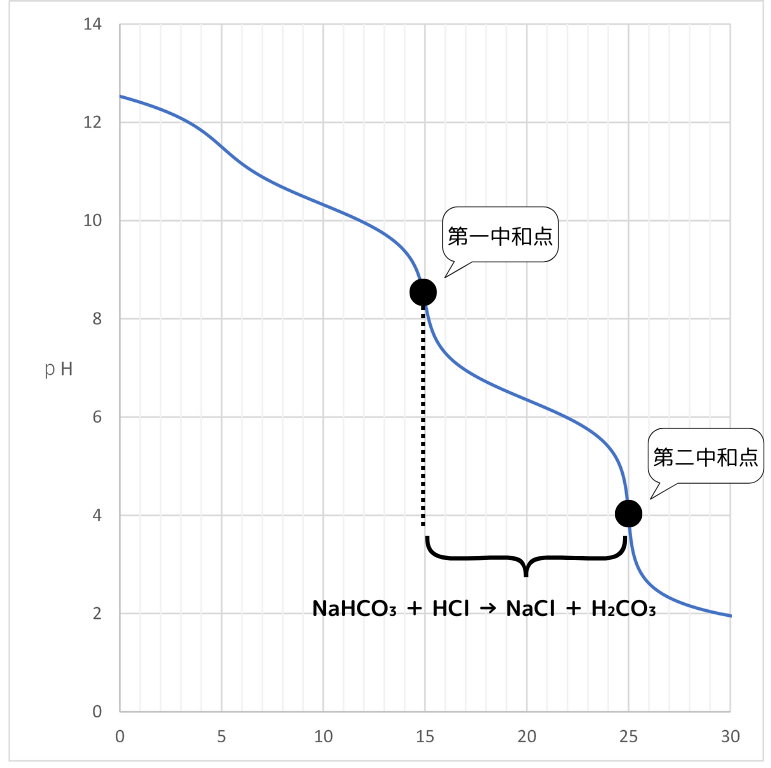
第二中和点まで滴定
この手順でNa₂CO₃の物質量を求めることが出来ます。
更にHClを滴下すると、次の反応が起こります。
NaHCO₃ + HCl → NaCl + H₂CO₃
Na₂CO₃の二段階中和の化学反応式を見るとNa₂CO₃とNaHCO₃の係数比が1:1であることがわかります。
つまり、第一中和点から第二中和点までに滴下したHClの物質量とNa₂CO₃の物質量には次の関係が成り立ちます。
第一中和点から第二中和点までに滴下した塩酸の物質量=NaHCO₃の物質量=Na₂CO₃の物質量
最後に、NaOHの物質量を求めます。
NaOHの物質量=NaOHとNa₂CO₃の物質量の和(手順2) ー Na₂CO₃の物質量(手順4)
ワルダー法の練習問題
以上がワルダー法の手順と原理です。
練習問題を解いて各量を計算で求めていきましょう。
問:NaOHとNa₂CO₃を含む混合溶液40mLにフェノールフタレインを加えて、0.1mol/Lの塩酸を滴下したところ、12mL加えたところで色が変化した。その後、メチルオレンジを加えて更に塩酸を滴下したところ、10mL加えたところで色が変化した。NaOHとNa₂CO₃のモル濃度をそれぞれ求めよ。
解答:タップで表示
NaOHの物質量をx、Na₂CO₃の物質量をyとする。
前半では、次の反応が完了する。
NaOH + HCl → NaCl + H₂O
Na₂CO₃ + HCl → NaHCO₃ + NaCl
NaOHとNa₂CO₃の物質量の和x+y=第一中和点までに滴下したHClの物質量であるから、
x+y mol = 0.1mol/L × \(\frac{12}{1000}\)L
= 1.2×10⁻³mol -①
後半では、次の反応が完了する。
NaHCO₃ + HCl → NaCl + H₂CO₃
Na₂CO₃の物質量y=第一~第二中和点までに滴下したHClの物質量であるから、
y mol = 0.1mol/L × \(\frac{10}{1000}\)L
= 1.0×10⁻³mol/L -②
②を①に代入すると
x = 2.0×10⁻⁴mol
したがって
NaOHのモル濃度 = \(\frac{2.0×10⁻⁴mol}{\frac{40}{1000}L}\)
= 5.0×10⁻³mol/L
Na₂CO₃のモル濃度 = \(\frac{1.0×10⁻³mol}{\frac{40}{1000}L}\)
= 2.5×10⁻²mol/L
ウィンクラー法
ウィンクラー法の手順と原理
ウィンクラー法は、次の手順で定量していきます。
- 混合溶液を2つに等分し、一方の溶液(以降A液と呼ぶ)にメチルオレンジを加える
- A液にメチルオレンジが変色するまでHClを滴下する→NaOHの物質量とNa₂CO₃の物質量×2の和を定量
- もう一方の溶液(以降B液と呼ぶ)に、これ以上て沈殿が生じなくなるまで塩化バリウムBaCl₂水溶液を加える→Na₂CO₃を除く
- B液にフェノールフタレインを加え、変色するまでHClを滴下する→NaOHの物質量を定量
順に見ていきましょう。
等分して一方にメチルオレンジを加える
ウィンクラー法では、混合溶液を2つに分けて定量していきます。
まず、A液にメチルオレンジを加えます。
ワルダー法とは違い、A液はNaOHとNaHCO₃を完全に中和させるためNa₂CO₃の第二中和点が分かるようメチルオレンジを使用します。
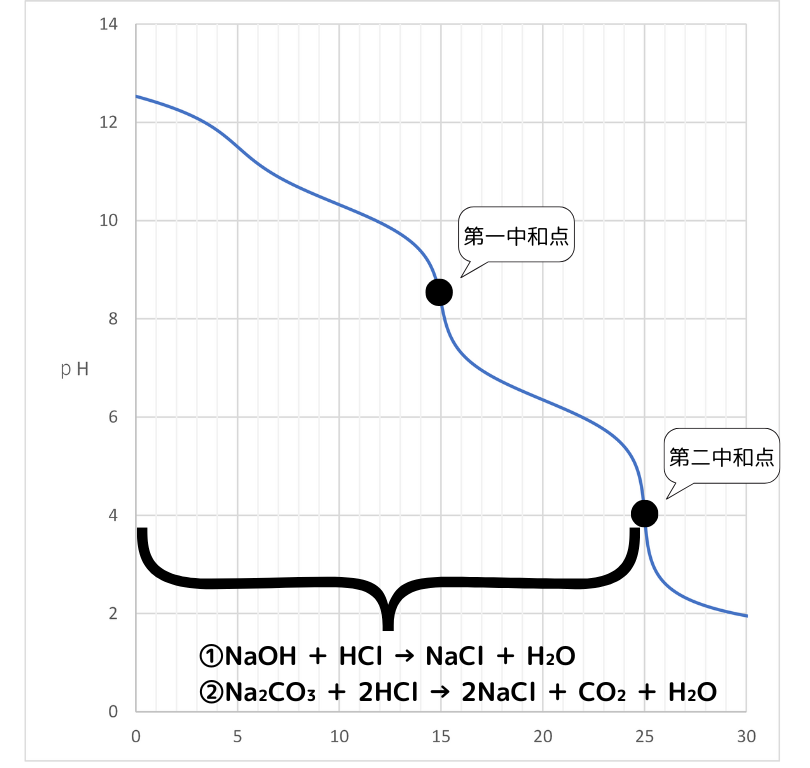
第二中和点まで滴定
この手順で、NaOHの物質量とNa₂CO₃の物質量×2の和を求めることが出来ます。
A液をHClで中和していくと、次の反応が起こります。
①NaOH + HCl → NaCl + H₂O
②Na₂CO₃ + 2HCl → 2NaCl + CO₂ + H₂O
それぞれの反応の係数比から、滴下したHClの物質量とNaOH・Na₂CO₃の物質量には次の関係が成り立ちます。
滴下したHClの物質量 = NaOHの物質量 + Na₂CO₃の物質量×2
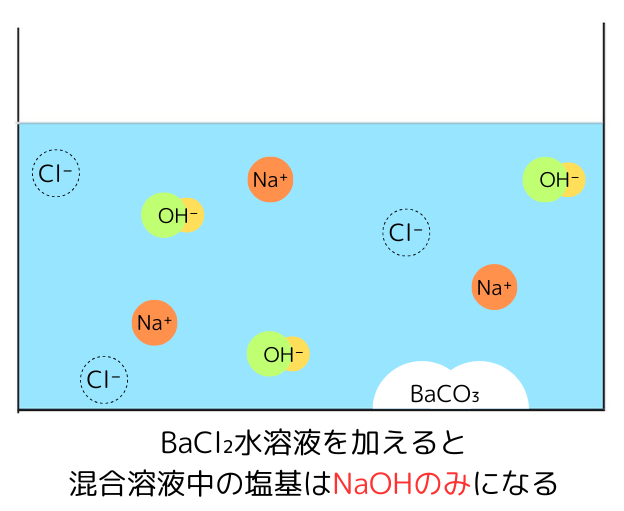
もう一方にBaCl₂水溶液を加える
B液に水酸化バリウムBaCl₂水溶液を加えると、次の反応が起こりNa₂CO₃を除くことが出来ます。
Na₂CO₃ + BaCl₂ → BaCO₃↓ + 2NaCl
この操作によって混合溶液中の塩基がNaOHのみになるため、NaOHの定量が可能になります。
フェノールフタレインを加えて滴定
指示薬にはフェノールフタレインを用います。(メチルオレンジを用いると、変色域が酸性に偏りBaCO₃が溶解するため正確な定量ができなくなります。)
HClを滴下すると、次の反応が起こります。
NaOH + HCl → NaCl + H₂O
このとき次の関係が成り立ちます。(復習)
滴下したHClの物質量 = NaOHの物質量
最後にNa₂CO₃の物質量を求めます。
Na₂CO₃の物質量=\(\frac{1}{2}\)×{NaOHの物質量とNa₂CO₃の物質量×2の和(手順2) ーNaOHの物質量(手順4)}
ウィンクラー法の練習問題
以上がウィンクラー法の手順と原理です。
練習問題を解いて各量を計算で求めていきましょう。
問:NaOHとNa₂CO₃を含む混合溶液60mLを30mLずつ別々の容器に取り、一方にはメチルオレンジを加えて0.5mol/Lの塩酸を滴下したところ、15mLで色が変化した。
また、もう一方には、白色沈殿が生じなくなるまで十分にBaCl₂水溶液を加え、フェノールフタレインを加えて0.5mol/Lの塩酸を滴下したところ、8mLで色が変化した。最初の混合溶液中(等分する前)のNaOHとNa₂CO₃の物質量を求めよ。
解答:タップで表示
最初の混合溶液中のNaOHの物質量をx、Na₂CO₃の物質量をyとする。
メチルオレンジを加えた方では、次の反応が完了する。
①NaOH + HCl → NaCl + H₂O
②Na₂CO₃ + 2HCl → 2NaCl + CO₂ + H₂O
x+2y=滴下したHClの物質量であるから、混合溶液60mL中の30mLであることに注意すると、
(x+2y)mol × \(\frac{30mL}{60mL}\) = 0.5mol/L × \(\frac{15}{1000}\)
x+2y = 1.5×10⁻²mol -①
フェノールフタレインを加えた方では、次の反応が完了して塩基がNaOHのみになる。
Na₂CO₃ + BaCl₂ → BaCO₃↓ + 2NaCl
この後の滴定ではx=滴下したHClの物質量であるから、同様にして、
x mol × \(\frac{30mL}{60mL}\)= 0.5mol/L × \(\frac{8}{1000}\)
x = 8.0×10⁻³mol -②
②を①に代入すると
y = 7.0×10⁻³mol


