- 溶解と溶液概要
- 質量パーセント濃度とモル濃度
- 濃度計算
溶液の濃度
溶解
ここでは、”溶液“に関することを学びます。
溶液は、溶解と呼ばれる現象によって作られます。
溶解:物質が液体に溶けて均一な液体(溶液)になること
また、溶解のときに溶ける物質のことを溶質、溶質を溶かす液体を溶媒と呼びます。
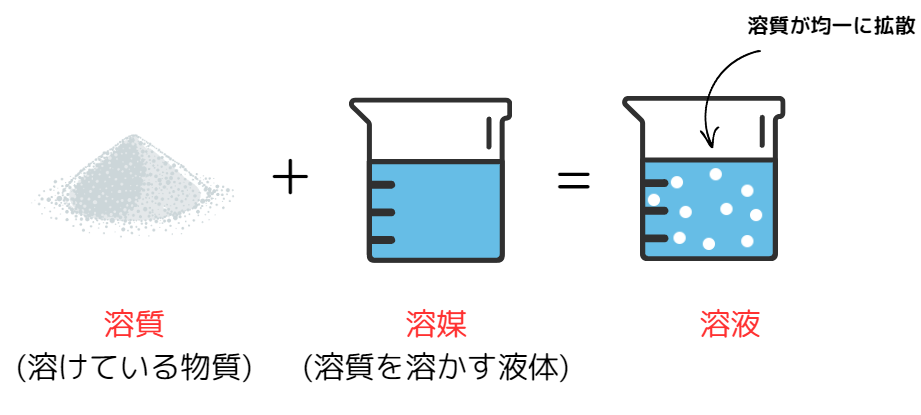
また、溶液の中でも溶媒が水であるものを水溶液と呼びます。
濃度
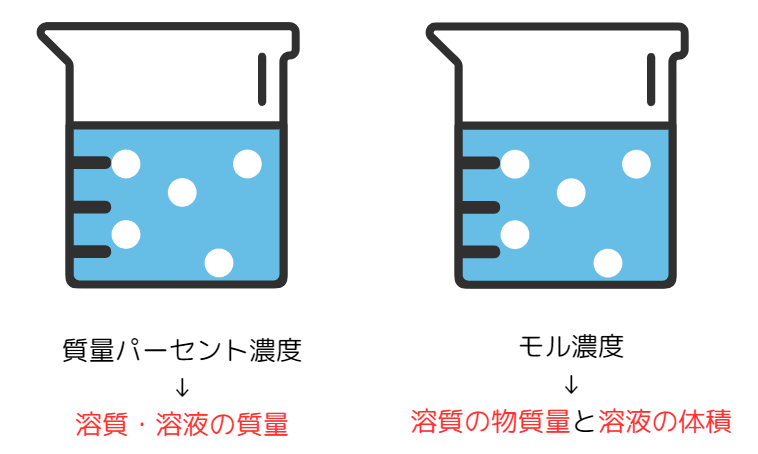
化学基礎では、濃度(溶液に溶質がどのくらい溶けているか)を2つ学びます。
「質量パーセント濃度」と「モル濃度」です。
質量パーセント濃度
質量パーセント濃度とは、溶液の質量に対する溶質の質量の割合です。
単位は%を使います。
$$質量パーセント濃度=\frac{溶質の質量(g)}{溶液の質量(g)}×100$$
(溶液の質量=溶質の質量+溶媒の質量)
例題を使って、質量パーセント濃度を求めてみましょう。
問:塩化ナトリウム20gを水180gに溶かしてできた塩化ナトリウム水溶液の質量パーセント濃度は何%か。
解答:タップで表示
溶質=塩化ナトリウム、溶媒=水、溶液=塩化ナトリウム水溶液
溶液の質量=溶質の質量+溶媒の質量だから、
\(質量パーセント濃度=\frac{20(g)}{20(g)+180(g)}×100\) = 10%
モル濃度
モル濃度とは、溶液1Lあたり溶けている溶質の物質量(mol)です。
単位はmol/Lを使います。
$$モル濃度=\frac{溶質の物質量(mol)}{溶液の体積(L)}$$
例題を使って、モル濃度を求めてみましょう。
問:水酸化ナトリウム4.0gを水に溶かして500mLにした溶液のモル濃度は何mol/Lか。原子量:H=1、O=16、Na=23とする。
解答:タップで表示
溶質=水酸化ナトリウム、溶媒=水(溶液=水酸化ナトリウム水溶液)
水酸化ナトリウムNaOHのモル質量は23+16+1=40だから、
溶質の物質量=\(\frac{4.0(g)}{40(g/mol)}\)=0.1mol
したがって、
溶液のモル濃度=\(\frac{0.1(mol)}{0.5(L)}\)=0.2mol/L
濃度のまとめ
どちらも溶質・溶液の値を扱いますが、使うものと意味が違います。
しっかりと理解して、濃度計算をできるようにしましょう。