- 原子と元素
- 単体と化合物
- 同素体とその例
- 2つの元素検出反応
- 水素・炭素・窒素の検出(+α)
原子と元素
ここからは、物質をより細かく見ていきます。
すべての物質は、原子と呼ばれる基本的な粒子で構成されています。スマホや文房具、水なども全て小さな粒子の集まりです。しかし、スマホと水が同じ原子から構成されているわけではありません。様々な種類があり、原子の種類を元素といいます。
元素は約120種類存在し、教科書の最初のページに載っている周期表にまとめられています。(この内容は、後で改めて勉強します。)
また、元素は元素記号を使って表されます。酸素ならばO、鉄ならばFeのように、元素と元素記号は1対1で対応しているのです。
単体と化合物
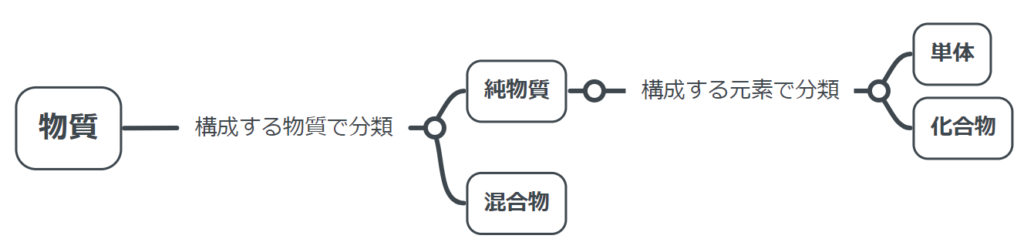
前回勉強した、「純物質」を元素の観点から2つに分けてみましょう。純物質は、「単体」と「化合物」に分ける事ができます。
- 単体:1種類の元素からなる純物質…酸素O₂、ダイヤモンドCなど
- 化合物:2種類以上の元素からなる純物質…水H₂O、二酸化炭素CO₂など
ここまで学んだ物質の分類を簡単にまとめます。
間違えやすいポイント
元素と単体は混同しやすく、この2つを判別する問題もよく見かけます。
この2つの違いは、概念か実物かです。
- 元素:原子の種類→概念
- 単体:1種類の元素からなる純物質→実物
元素とは種類であるので概念、単体とは純物質の1種であるため実物となります。例題を使って確認してみましょう。
- 水は、水素と酸素で構成されている。
- 空気中には、窒素と酸素が多く含まれている。
1の酸素は水(H₂O)を構成する元素です。実際に、この「酸素」は実物ではなく概念のことを指していますね。
2の酸素は空気中に存在する実物のことなので単体です。
このように概念と実物を考えれば、難なく元素と単体を判別できます。
同素体
次に、単体の特殊なケースについて見ていきましょう。それが、同素体です。
同素体:同じ元素からなるが、性質が異なる単体
この記事ではC(炭素)、P(リン)、O(酸素)、S(硫黄)をまとめます。
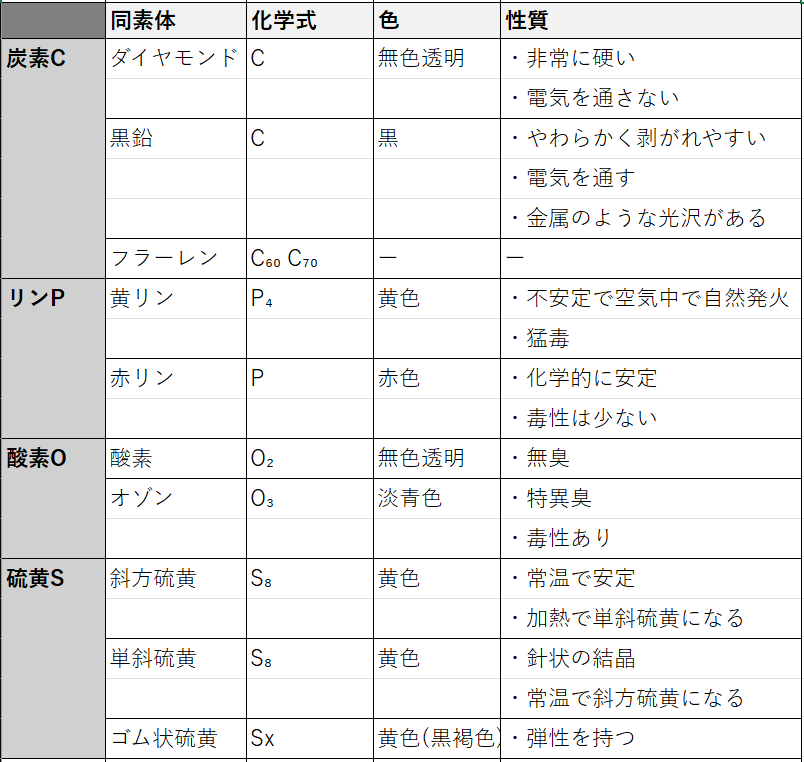
それぞれの同素体名・色・性質はよく覚えておきましょう。
成分元素の検出
物質に含まれている元素を調べるための方法を2つ学びます。それが、炎色反応と沈殿反応です。
炎色反応
元素の中には、炎の中にいれると特有の色を示すものがあります。この反応を炎色反応と呼びます。
高校化学で出てくる炎色反応の例は、下の7つです。
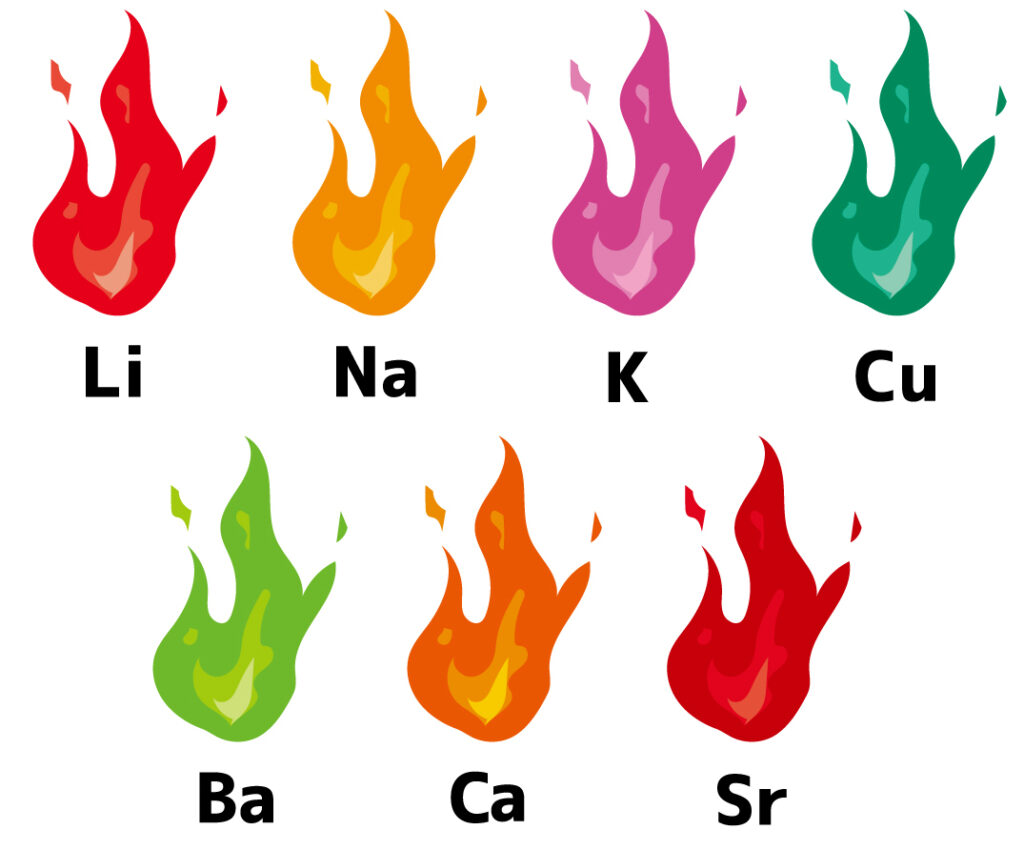
有名な語呂合わせがあるので、ここで覚えてしまいましょう。
「リアカー・Li(赤) なき・Na((黄) K村・K(紫) 動力・Cu(緑) 借りるとう・Ca(橙) するもくれない・Sr(紅)、 馬力・Ba(黄緑) で行こう!」
沈殿反応
固体には、溶けやすいものと溶けにくいものがあります。例えば、塩化ナトリウム(食塩)は水に溶けますが、砂糖は水に溶けませんね。
液体中に固体が溶けずに底に沈む現象を沈殿と呼び、この沈殿を起こす反応を沈殿反応と呼びます。
沈殿の有無を確認することによって、元素を調べることができます。
例えば、食塩水に硝酸銀水溶液(AgNO₃)を加えると、白色沈殿が生じます。
この白色沈殿の正体はAgClであり、食塩水中にClが含まれている事がわかります。
このように、未知の液体に試薬を入れて沈殿を確認することで、元素を検出することができます。
+α
元素の検出の発展内容です。水素・炭素・窒素の検出方法について見ていきましょう。(「化学」で勉強する有機化学でこの知識が必要になります。)
水素の検出
水素は水を検出することによって確認します。
物質中の水素を化学反応で水に変化させ、下記の方法で確認することで間接的に水素を検出することができます。
- 塩化コバルト紙(水で青→赤)の変化を確認
- 硫酸銅(Ⅱ)無水物(水で白→青)の変化を確認
炭素の検出
炭素は二酸化炭素を検出することによって確認します。
水素と同様、炭素を二酸化炭素に変化させ下記の方法で間接的に検出します。
- 石灰水の白濁を確認
窒素の検出
窒素はアンモニア(NH₃)を検出することによって確認します。
水素・炭素と同様、窒素をアンモニア変化させ下記の方法で間接的に検出します。
- リトマス紙が赤→青に変化を確認(アンモニアはアルカリ性のため)
- アンモニアをの濃塩酸で塩化アンモニウムに変化させ、白煙を確認
※塩化アンモニウムは白煙として見えます。



コメント