- 拡散と熱運動
- 絶対温度
- 物質の三態
- 状態変化
拡散と粒子の熱運動
この記事のキーワードとも言える、熱運動から説明します。
熱運動:物質を構成する粒子(原子・分子など)が常に行っている運動
物質は、その状態(固体・液体・気体)に関わらず熱運動をしています。
熱運動を考えることによって様々な現象が説明できます。その1つが拡散です。
拡散:物質が自然にゆっくりと全体に広がる現象
例えば、水に赤色のインクを垂らすと徐々に広がっていき、時間が経つと水全体が赤くなります。
この拡散は、粒子が熱運動しているから起こる現象です。
熱運動することで粒子は留まらず常に動き続けるため、物質は自然と全体に広がります。
気体分子の熱運動と絶対温度
気体分子の運動エネルギー
粒子は熱運動しているため、速さを持っていることになります。また、粒子の速さは温度と密接な関係があります。
ここでは、気体分子(粒子)と温度の関係を例にとって見てみましょう。
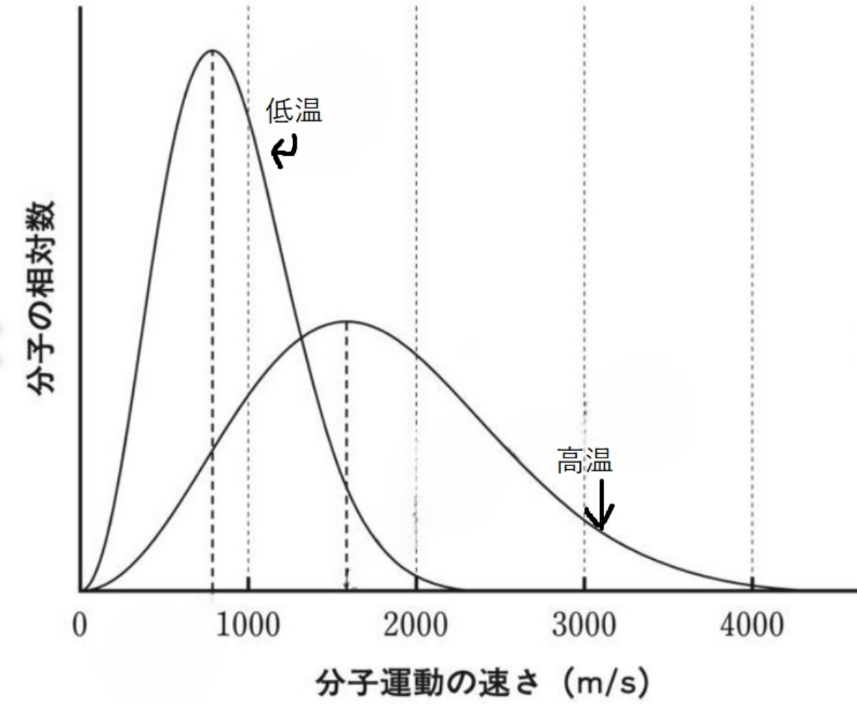
縦軸は分子の数、横軸は分子の速さです。
上記のグラフから読み取れることは、温度が高いほど速い分子の数が多くなることです。
また、気体分子が熱運動をしている=気体分子が運動エネルギーを持っているということになります。
運動エネルギーについて復習しましょう。
運動エネルギー:運動している物体が持つエネルギー。物体の速さ・質量が大きくなるほど運動エネルギも大きくなる。
まとめると温度と速さ、速さと運動エネルギーの関係から
温度が高いほど速さが大きい分子(運動エネルギーが大きい分子)の数が大きくなると言えます。
気体の圧力
気体分子が入っている容器を考えます。気体分子は熱運動をしているため容器の壁に衝突します。このとき、容器は気体分子から力を受けています。
気体分子はたくさん容器内に存在しますから、容器は全体として一定の力を受けています。単位面積に受けるこのような力を圧力と呼びます。
圧力は、温度と分子の数にします。これは、温度が高いほど分子がより強く壁に衝突し、分子の数が多いほど力も増えるからです。
絶対温度
まず、絶対零度について。
絶対零度:気体分子が完全に熱運動を停止する温度、-273℃。
気体分子の熱運動と温度の関係は比例することがわかり、絶対零度は温度の最小値です。そして、この絶対零度を基準とした温度が絶対温度です。
絶対温度:絶対零度を基準とした温度。単位はケルビン(K)を使い、目盛りの間隔はセルシウス温度(℃)と同じ。
今後の化学の計算では、セルシウス温度を絶対温度に変換する操作もあります。
セルシウス温度と絶対温度の関係式は次のとおりです。
T[K] = t[℃] + 273
物質の三態と熱運動
物質には、三態「固体・液体・気体」があります。また、この三態間の変化を状態変化と呼びます。
状態変化の関係図は以下のとおりです。
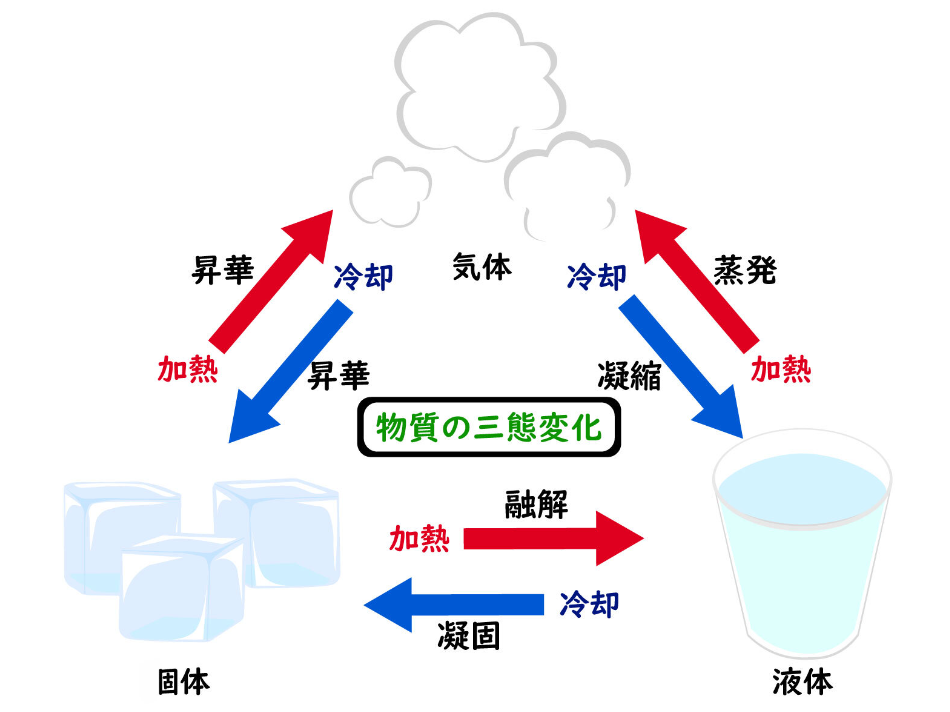
どの状態変化も覚えておきましょう。
ここで、物質の三態を熱運動と分子間力で考えていきましょう。(分子間力:分子間にはたらく引力、あとで詳しく勉強します。)
物質の状態は、熱運動と粒子間の引力の大きさで決まります。下の図は、水の三態における粒子の様子です。
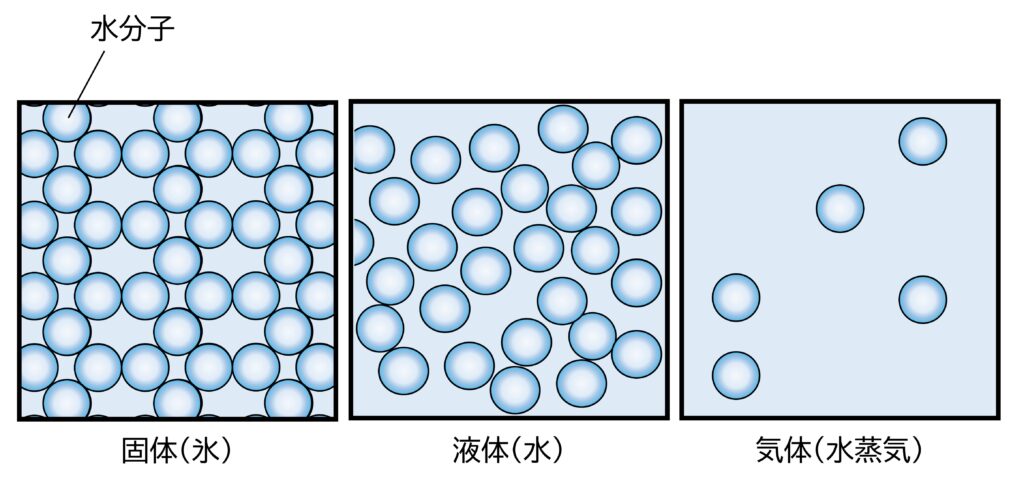
固体<液体<気体で熱運動は激しくなり、分子間の距離が大きくなります。また、分子間の距離が大きくなるほど分子間力は弱くなります。
状態変化
沸騰と蒸発
液体→気体への変化を蒸発といいますが、似たような言葉に沸騰があります。この2つの言葉の違いを確認しましょう。
- 蒸発:液体が気体になる現象、常温でも起こる。
- 沸騰:液体内部からも気体が発生する現象、起こる温度は決まっている(沸点)。
蒸発の方がより広義的であるといえます。
状態変化と温度
次は、状態変化を温度で考えていきましょう。ここで出てくる温度が、融点と沸点です。
- 融点:融解が起こる温度
- 沸点:沸騰が起こる温度
融点と沸点は各物質で決まっています。例えば水は融点0℃、沸点100℃です。
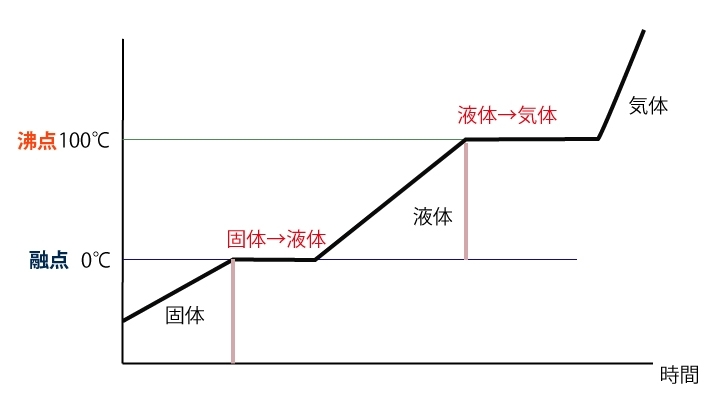
また、融点は凝固が起こる温度である凝固点と同じ温度です。
上のグラフのように、固体→液体、液体→気体のとき温度は一定になります。
これは、固体→液体の際に使われる熱(融解熱)は結晶構造を崩すために、液体→気体の際に使われる熱(蒸発熱)は分子間力を断ち切るために使われるからです。
+α
圧力と気体分子数・温度の関係
圧力と気体分子数・温度の関係は化学で学ぶ気体の状態方程式を考えると簡単に理解できます。
気体の状態方程式
PV=nRT (P:圧力 V:体積 n:物質量 R:気体定数 T:温度)
上の式から、圧力が気体分子数(物質量)と温度に比例することが分かります。



コメント