- 物質量とアボガドロ定数
- モル質量・モル体積
- アボガドロの法則
- 計算のコツ(+α)
物質量と粒子の数
身の回りの物質を原子や分子などの粒子単位で数えると、数が大きすぎて扱いづらいことがすぐに分かります。
例えば、鉄1gに含まれる鉄原子の数は、およそ1.07×10²²個になります。
使いづらい原子の質量に対して相対質量があるのと同じように、
粒子の数に対応する使いやすいもの、物質量があります。
物質量:6.02×10²³個の粒子を1まとまり(=1mol)に変換して、molという単位で表した物質の量
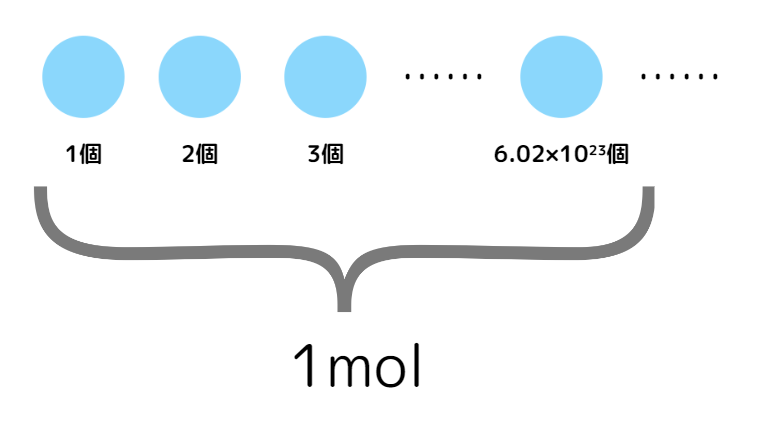
また、このときの6.02×10²³/mol(1molあたりの粒子の数)のことをアボガドロ定数と言います。
例題を使って、粒子の数→物質量への変換について確認しましょう。
問:酸素分子1.806×10²⁴個の物質量は何molか、アボガドロ定数を6.02×10²³/molとする。
解答:タップで表示
酸素分子の物質量は、(酸素分子の数)÷(1molあたりの粒子の数=アボガドロ定数)だから
酸素の物質量= 1.806×10²⁴ ÷ 6.02 × 10²³/mol
= 3mol
物質量と質量
物質量と質量の関係について見ていきましょう。
1molあたりの質量をモル質量(単位:g/mol)と呼びます。
モル質量の特徴は、原子量・分子量・式量と大きさが同じことです。
- ヘリウムHe(原子量4)のモル質量=4g/mol
- 水H₂O(分子量18)のモル質量=18g/mol
- アルミニウムAl(式量27)のモル質量=27g/mol
こちらも例題を使って、質量→物質量への変換を確認しましょう。
問:黒鉛30gの物質量は何molか、炭素の原子量を12とする。
解答:タップで表示
黒鉛(C)の物質量= (黒鉛の質量) ÷ (1molあたりの黒鉛の質量=黒鉛のモル質量)であり、
黒鉛のモル質量= 12g/molだから
黒鉛の物質量=30g ÷ 12g/mol
=2.5mol
物質量と気体の体積
アボガドロの法則
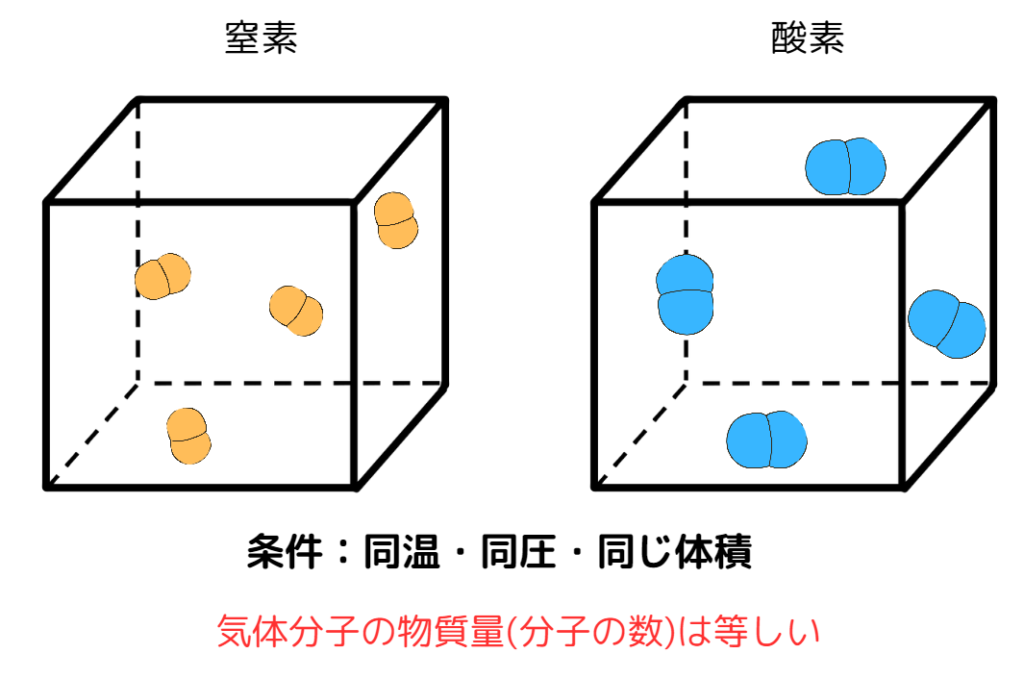
気体の体積と気体に含まれる分子の数の関係を表すものに、アボガドロの法則があります。
アボガドロの法則:同温・同圧のもとで、全ての気体は同じ体積中に同じ数の分子が含まれている。
簡単に言うと、「温度・圧力・体積が同じだったら、どんな気体でも分子の数が一致する」ということです。
モル体積
1molあたりの質量をモル質量と言うように、1molあたりの体積をモル体積と呼びます。
先ほどのアボガドロの法則から、温度・圧力・分子の数(物質量)を決めれば体積が決まります。
モル体積を求めたいので分子の数=1molに、温度と圧力は標準状態(温度=0℃、圧力=1.013×10⁵Pa)と呼ばれる状態にすると、モル体積は22.4L/molとなります。
気体の密度と分子量
密度とは、単位面積あたりの質量のことです。
一般的に物質の密度を表す際の単位はg/cm³を使いますが、化学ではcm³をLに変換することがよくあります。気体の体積はLを使って表すため、気体の密度はほとんどの場合単位にg/Lを使用します。
空気1molの体積と質量
純物質と混合物で紹介した通り、空気の主成分は窒素N₂と酸素O₂であり、その割合は4:1です。
ここまでの勉強したことを使えば、標準状態・体積22.4Lにおける空気の分子量や密度を求めることができます。
例題を使って求めていきましょう。
問:空気は窒素N₂と酸素O₂の混合物であり、その割合は4:1である。原子量:N=14、O=16として次の問に答えよ。
問1.空気の見かけの分子量(平均分子量)を求めよ。
問2.標準状態で22.4Lの空気の質量は何gか。また、密度は何g/Lか。
解答:タップで表示
問1.N₂とO₂の分子量は28と32であり、割合は4:1だから
空気の平均分子量 = 28×4/5 + 32×1/5
= 28.8
問2.空気は標準状態で22.4Lだから、空気の物質量は1molである。
また、問1より空気のモル質量は28.8g/molであると分かるから
空気の質量= 28.8g/mol × 1mol
= 28.8g
空気の密度= 28.8g ÷ 22.4L
= 1.285…g/L
≒ 1.29g/L
+α
計算のコツ
この単元から、化学の計算が本格的にスタートします。
molからgへの変換・個数からmolへの変換などは、慣れないと難しく感じると思います。
計算のコツは、「単位で掛け算・割り算をすること」です。
例題を使って見てみましょう。
問:水素0.15molは、標準状態で何Lか。
解説:
この問題は、mol→Lなので単位だけで式を立てると
mol(物質量) × L/mol(何か) = L(体積)
となります。
”何か”はL/molを単位とするものであるモル体積、標準状態なので22.4L/molですね。
したがって結果は下のようになります。
0.15mol × 22.4L/mol = 3.36L
問:アルミニウム54g中のアルミニウム原子の数は何個か、アボガドロ定数を6.0×10²³/mol、Alの原子量を27とする。
解説:
この問題は、g→個数 ですがいきなりは変換できません。
アボガドロ定数が使えるので、g→mol→個数と変換していきましょう。
- g(質量) ÷ g/mol(何か) = mol(質量)
- mol(物質量) × 個数/mol(アボガドロ定数) = 個数
“何か“は単位がg/molのものであるモル質量、モル質量の値は原子量と同じなので27g/molですね。
したがって結果は下のようになります。
- 54g÷27g/mol=2mol
- 2mol×6.0×10²³/mol=1.2×10²⁴
以上のように単位を中心に考えることで、計算がやりやすくなります。


