- 物質とはなにか
- 純物質と混合物とはなにか
- 物質の分離・精製6つ
純物質と混合物
物質を分類する前に、まず物質とはなんでしょうか。
物質とは、人間が認知できる大きさと重さをもつモノのことです。身の回りにある全てのモノは物質であると言えます。逆に物質でないものの例は、時間や空間などの概念、光などがあります。
物質を2種類に分けると、「純物質」と「混合物」に分けられます。
- 純物質:1種類の物質からなる物質…水・酸素・塩化ナトリウムなど
- 混合物:2種類以上の物質からなる物質…石油・空気・海水など
純物質には固有の沸点・融点・密度などが決まっているので、混合物の沸点・融点・密度などは一定ではなく、その成分によります。
物質の分離・精製
上述のとおり、身の回りのほとんど全てのものは混合物であるため純物質を得るには混合物から分ける必要があります。その操作が分離と精製です。
- 分離:混合物から目的の物質を得る操作
- 精製:不純物を取り除き、分離よりも純度の高い物質を得る操作
高校化学では、6つの分離方法を学びます。(資料集等で実験の様子を参照しましょう。)
ろ過
液体と溶けない固体をろ紙などを使って分離する操作です。ろ過でよく使う紙をろ紙、ろ紙を通過する液体をろ液といいます。
例えば、砂が混ざった水をろ過するとろ紙に砂が残り、水がろ紙を通過します。
蒸留(分留)
液体と固体の混合物を、液体を蒸発させて分離する操作です。
蒸留の手順は次の通りです。
- 混合物を加熱し液体を蒸発(このとき固体は蒸発しない)
- 蒸発した液体(気体)を回収し冷却
具体例は、塩化ナトリウム水溶液を蒸留すると、塩化ナトリウム(固体)と水(液体)に分離できます。
また、蒸留の1つに分留(分別蒸留)があります。
分留とは、2種類以上の液体を、沸点の差を利用して分離する操作のことです。分留の手順は次の通りです。
- 混合溶液を加熱する
- 目的の物質が蒸発したら、蒸気を回収し冷却する
具体例は、石油の分離・エタノールと水の分離を分留で行います。
昇華
物質の状態変化である昇華を用いて分離する操作です。(昇華とは固体が液体にならず直接気体になる現象のことです。)
昇華しやすい物質は限られていて、頻出なものはヨウ素・ナフタレン・ドライアイスです。
再結晶
固体の溶解度の違いや溶媒の蒸発を利用して分離する操作です。(溶解度:溶質が一定量の溶媒にとける限界量)後者は蒸留と同じですが、取り出す物質が異なります(蒸留は液体、再結晶は固体)。
取り出せる固体は溶解度が温度で大きく変化する物質、例えばミョウバンなどです。
抽出
目的の物質のみを溶かして分離する操作です。
例えばヨウ素は、水には溶けづらくヘキサンと呼ばれる有機溶媒には溶けやすいです。(これは、後に化学で学びます。)
このように、目的の物質が溶けやすい溶媒を用いて分離します。
私達の身の回りでは、コーヒーはコーヒー豆から味や香りを抽出しています。
クロマトグラフィー
ろ紙やシリカゲルなどに対する吸着力と溶媒への溶けやすさの違いを利用して分離する操作です。
紙を使うペーパークロマトグラフィー、シリカゲルなどの吸着剤をガラス管に試料をいれ上から溶媒を流すと分離されるカラムクロマトグラフィーなどの種類があります。
+α
空気と海水
混合物の例として、空気と海水がよくあげられます。この2つの成分上位5つをまとめます。
| 空気の成分 | 割合 | 水の成分 | 割合 |
|---|---|---|---|
| 窒素 | 78.1% | 水 | 96.5% |
| 酸素 | 20.9% | 塩化ナトリウム | 2.72% |
| アルゴン | 0.9% | 塩化マグネシウム | 0.38% |
| 二酸化炭素 | 0.04% | 硫酸マグネシウム | 0.17% |
| ネオン | 0.0018% | 硫酸カルシウム | 0.13% |
空気中に3番目に多い物質が二酸化炭素ではなくアルゴンであること、海水中に3番目に多い物質が塩化マグネシウムであることは覚えておくといいでしょう。
実験器具の注意点
分離・精製にしようする器具には、使用する際に注意すべき点があります。
まず、ろ過について。注意することは以下の3点です。
- ガラス棒の先はろ紙につけ、混合物をガラス棒に伝わらせていれる
- ろ紙をろうとに密着させ、蒸留水で湿らせる
- 漏斗の先はビーカーの内側につける
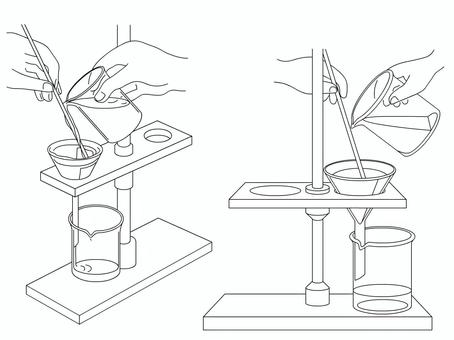
次に蒸留について、注意点は以下の5点です。
- 沸騰石を入れる
- 枝付きフラスコにいれる溶液の量は半分以下にする
- 温度計の球部はフラスコの枝元に来るようにする
- リービッヒ冷却器は下から上へ通す
- アダプターと受け器は密閉しない
入試にも頻出なので、覚えておきましょう。




コメント