- 酸化剤・還元剤とその例
- 半反応式
- 酸化還元反応の反応式の作り方
- 酸化還元反応と量的関係
酸化剤・還元剤とそのはたらき
酸化剤と還元剤
酸化還元反応では、酸化剤・還元剤という呼び方で物質を区別します。
酸化剤:相手の物質を酸化する物質。反応するとき、自身は還元する。
還元剤:相手の物質を還元する物質。反応するとき、自身は酸化する。
酸化剤・還元剤のはたらきを示す反応式
酸化剤・還元剤のはたらきを電子e⁻を使って表したイオン式を、半反応式と呼びます。
ここでは、高校化学で頻出の酸化剤・還元剤の半反応式をまとめます。
【酸化剤】
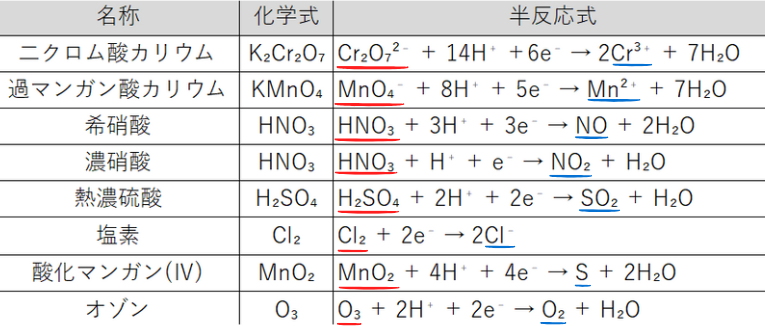
【還元剤】
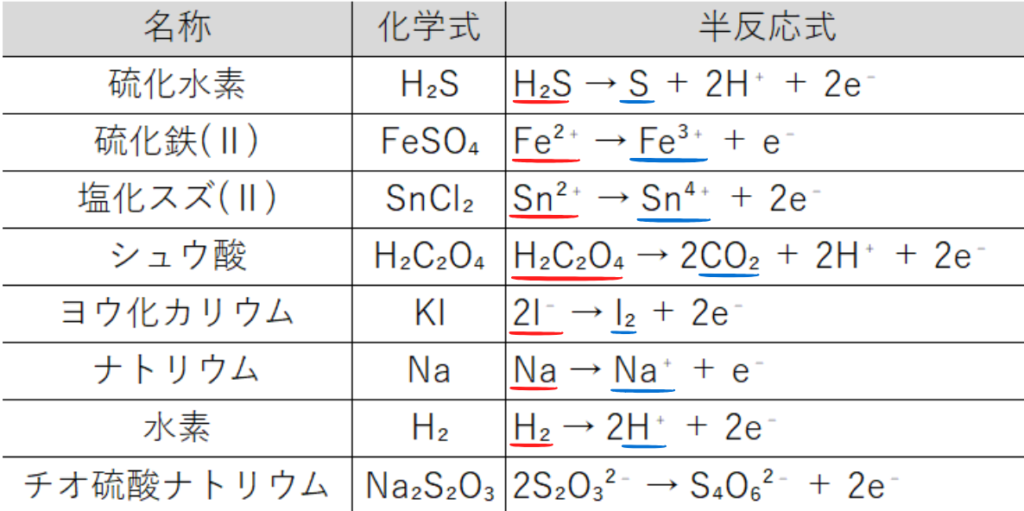
【酸化剤・還元剤の両方になる物質】
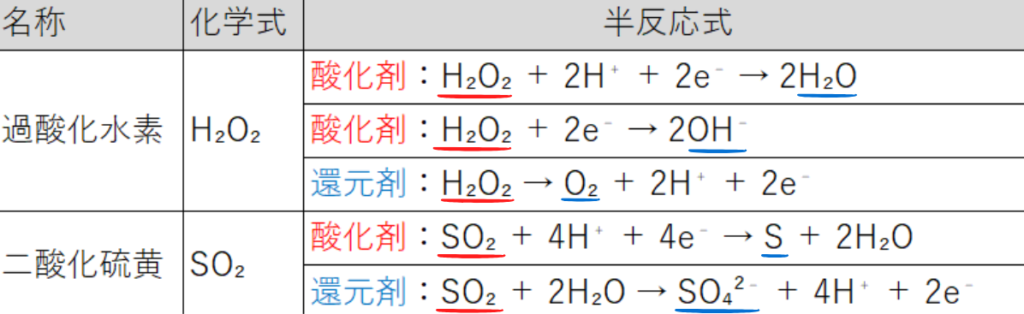
過酸化水素が酸化剤としてはたらくとき、水溶液の性質によって半反応式が異なります。
酸性水溶液中なら上の半反応式(H₂O₂ + 2H⁺ + 2e⁻ → 2H₂O)
中性・塩基性水溶液中なら真ん中の半反応式(H₂O₂ + 2e⁻ → 2OH⁻)になります。
半反応式の作り方
上にまとめた半反応式は、酸化還元反応の反応式を作るうえで覚える必要があります。
しかし、半反応式全体を覚える必要はありません。
酸化剤・還元剤となる物質の「名称」「化学式」「反応前・反応後の物質(赤・青下線)」だけ覚えればOKです。
半反応式の作り方は次の4ステップです。
- 反応の前後で酸化数の変化した物質を書く(上表の青線と赤線の物質)
- 酸化数の変化量分、電子e⁻を加える
- 両辺の電荷を合わせるためH⁺を加える
- 酸素原子の数を合わせるためH₂Oを加える
例題で実際に作っていきましょう。
問:次の物質は酸化剤・還元剤のどちらとしてはたらくか。また、そのはたらきを示す半反応式を作れ。
(1)過マンガン酸カリウム
(2)硫化水素
(1)の解答:
過マンガン酸カリウムKMnO₄は、酸化剤としてはたらきます。
そして、「MnO₄⁻ → Mn²⁺」と変化します。(少しずつ覚えていきましょう。)
まずステップ1、作っていみると酸化数が5減っていることが分かります。
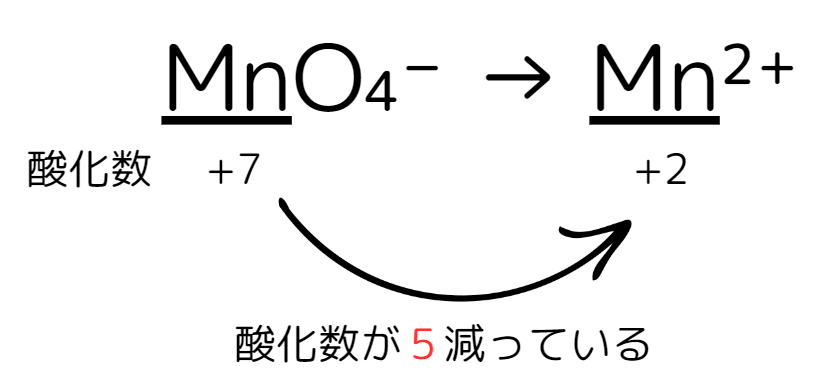
次にステップ2、左右の酸化数をe⁻で揃えてきます。

(便宜上電子の酸化数を-5としていますが、酸化数の定義から誤りです。あくまで考え方の1つであることをご理解ください。)
次にステップ3、次は左右の電荷をH⁺で揃えていきます。
上の式は左辺の電荷が(-1)+5×(-1)=-6、右辺の電荷が+2なので下のように揃えられます。

最後にステップ4,酸素原子の数をH₂Oで揃えます。
これで、半反応式の完成です。

(2)の解答:
硫化水素H₂Sは、還元剤としてはたらきます。
そして、「H₂S → S」と変化します。
(1)と同様に半反応式を作っていきます。

これで、半反応式の完成です。
この半反応式のように、酸素がない場合はステップ4まで行う必要はありません。
酸化剤と還元剤の反応
酸化剤・還元剤の半反応式を作れるようになれば、酸化還元反応の反応式は簡単に作ることができます。
酸化還元反応の反応式の作り方は、次の3ステップです。
- 酸化剤と還元剤の半反応式を書く
- 各半反応式を整数倍して、電子e⁻を打ち消す(イオン反応式を得る)
- 省略されたイオンを補う
こちらも、例題を使って作っていきましょう。
問:過酸化水素水H₂O₂水に希硫酸を加え、過マンガン酸カリウムKMnO₄で過不足なく滴定した。この反応の化学反応式を答えよ。
解答:
例題における酸化剤はKMnO₄、還元剤はH₂O₂です。
まずはステップ1、それぞれの半反応式を書きます。

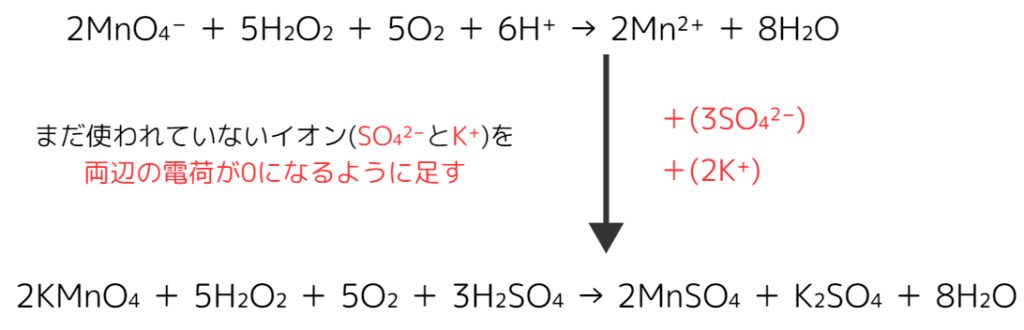
ステップ2,電子の数を同じにして式を足し、電子を打ち消します。

ステップ3、この反応で省略されたイオンは希硫酸由来のSO₄²⁻と過マンガン酸カリウム由来のK⁺です。両辺の電荷が0になるように足すと完成です。
酸化還元反応の量的関係
酸化還元反応の量的関係
ここまでの勉強で、酸化還元反応は電子による反応であると分かりました。
酸化剤・還元剤が過不足なく反応するとき、「酸化剤が受け取る電子の物質量」と「還元剤が失う電子の物質量」が等しくなります。
酸化剤が受け取るe⁻物質量 = 還元剤が失うe⁻の物質量
酸化還元滴定
中和には中和滴定があるように、酸化還元には酸化還元滴定があります。
酸化還元滴定:濃度が未知の酸化剤(または還元剤)の濃度を、濃度が分かっている還元剤で滴定し決定する操作。
酸化還元滴定にはいくつか種類があり、代表的なのが過マンガン酸塩滴定です。
過マンガン酸イオンの色の変化を利用した滴定
過マンガン酸ナトリウムなどの塩は、水に溶かすと濃い赤紫色のMnO₄⁻(還元剤)が生じます。
酸化剤として反応したあとに生じるMn²⁺は無色のため、色が変化したところが酸化還元反応の終点を表し、滴定が完了するという仕組みです。
酸化還元滴定の計算問題は、量的関係を使って解きます。
電子の物質量が重要になるため、半反応式のまま最後まで解くことがほとんどです。
例題で実際に解いてみましょう。
問:濃度不明の過酸化水素H₂O₂水を20mLとって希硫酸を加え、1.0×10⁻²mol/Lの過マンガン酸カリウムKMnO₄で滴下したところ、12mL加えたところでKMnO₄水溶液の赤紫色が消えてなくなった。このH₂O₂水の濃度は何mol/Lか。
解答:
酸化剤であるKMnO₄と還元剤であるH₂O₂の半反応式は、次のようになります。
酸化剤: MnO₄⁻ + 8H⁺ + 5e⁻ → Mn²⁺ + 7H₂O
還元剤: H₂O₂ → O₂ + 2H⁺ + 2e⁻
酸化剤と還元剤が過不足なく反応しているので、「酸化剤が受け取るe⁻物質量 = 還元剤が失うe⁻の物質量」が成り立ちます。
半反応式から、過マンガン酸カリウムと受け取る電子の比は「1:5」、過酸化水素と失う電子の比は「1:2」と分かります。
よって、H₂O₂水の濃度をaとすると、



