- 金属のイオン化傾向
- 金属の反応性(空気・水・酸)
金属のイオン化傾向
イオン化傾向とイオン化列
銀イオンを含む水溶液(例えばAgNO₃水溶液)に銅の単体を入れると、次のような酸化還元反応が起こり銀が析出します。
2Ag⁺ + Cu → 2Ag +Cu²⁺
この反応は、銅が銀よりも陽イオンになりやすいため起こる反応です。
逆に、銅イオンを含む水溶液に銀の単体を入れても銅は析出しません。
この例と同じように、NaやFeなどの金属にも「陽イオンへのなりやすさ」が決まっており、このような性質を金属のイオン化傾向と呼びます。
金属のイオン化傾向:金属が水または水溶液中で陽イオンになろうとする性質。陽イオンになりやすい金属ほどイオン化傾向が大きいという。
また、金属をイオン化傾向が大きい中から並べたものを金属のイオン化列といいます。高校化学では、次の金属のイオン化列を覚える必要があります。
(大)Li K Ca Na Mg Al Zn Fe Ni Sn Pb (H₂) Cu Hg Ag Pt Au(小)
金属のイオン化列は語呂合わせで覚えましょう。
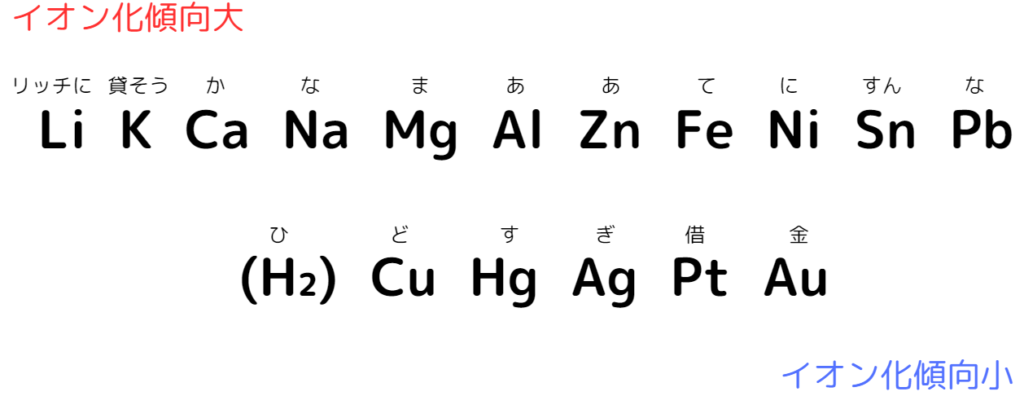
イオン化傾向の大小
イオン化傾向の大小を例題を使って確認しましょう。
問:次の金属を、イオン化傾向が大きい順に並び替えろ。
(1)Cu,Zn
(2)Ag,Fe,Pb
(3)Ca,Al,Pt,Sn
解答:タップで表示
(1)Zn,Cu
(2)Fe,Pb,Ag
(3)Ca,Al,Sn,Pt
イオン化傾向と金属の反応性
イオン化傾向の大小によって金属の反応性は異なります。
以下の表は、金属のイオン化列と空気・水・酸との反応についてまとめたものです。
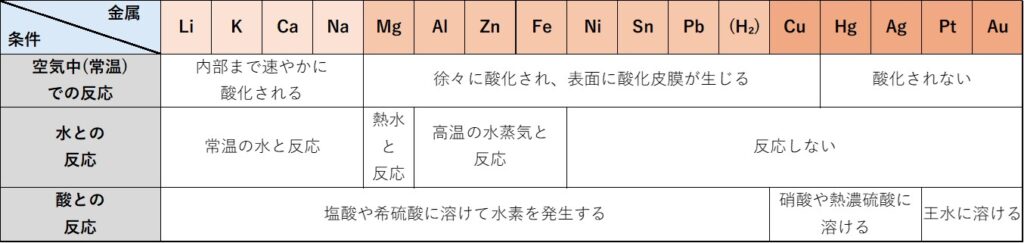
金属と空気の反応
イオン化傾向が大きいLi・K・Ca・Naなどのアルカリ金属・アルカリ土類金属は、空気中では速やかに内部まで酸化されます。
4Na + O₂ → 2Na₂O
2Ca + O₂ → 2CaO
イオン化列でMg~Cuまでの金属は空気中で徐々に酸化され、表面に酸化皮膜が生じます。
2Mg + O₂ → 2MgO
4Al + 3O₂ → 2Al₂O₃
これらに対し、イオン化傾向の小さいHg・Ag・Pt・Auは空気中で酸化されることはありません。
金属と水の反応
イオン化傾向が大きいLi・K・Ca・Naなどの金属は、常温の水でも激しく反応し水酸化物になります。同時に水素を発生させます。
ナトリウムと水の反応:2Na + 2H₂O → 2NaOH + H₂↑
カルシウムと水の反応:Ca + 2H₂O → Ca(OH)₂ + H₂↑
Mgは常温の水にはほとんど反応せず、熱水と反応して水素を発生させます。
マグネシウムと熱水の反応:Mg + 2H₂O → Mg(OH)₂ + H₂↑
Al・Zn・Feは常温の水・熱水と反応せず、高温の水蒸気と反応します。
Ni~Auの金属は、水といかなる条件でも反応することはありません。
金属と酸の反応
イオン化傾向>H₂
イオン化傾向が水素よりも大きい金属は、塩酸や希硫酸などの酸と反応して水素を発生します。(酸のH⁺よりも上記金属はイオンになりやすいため)
アルミニウムと塩酸の反応:2Al + 6HCl → 2AlCl₃ + 3H₂↑
亜鉛と希硫酸の反応:Zn + H₂SO₄ → ZnSO₄ + H₂↑
イオン化傾向<H₂
イオン化傾向が水素よりも小さい金属の中で、Cu・Hg・Agは酸化力が大きい硝酸や熱濃硫酸などに溶けます。このとき水素は発生せず、希硝酸では一酸化窒素NOが、濃硝酸では二酸化窒素NO₂が、熱濃硫酸では二酸化硫黄SO₂が発生します。
銅と希硝酸の反応:3Cu + 8HNO₃ → 3Cu(NO₃)₂ + 4H₂O + 2NO↑
銅と濃硝酸の反応:Cu + 4HNO₃ → Cu(NO₃)₂ + 2H₂O + NO₂↑
銅と熱濃硫酸の反応:Cu + 2H₂SO₄ → CuSO₄ + 2H₂O + SO₂↑
残りのPt・Auは唯一王水(濃硝酸と濃塩酸の体積比が1:3の混合物)と呼ばれる酸化力がきわめて高い溶液に溶けます。
不動態
Al・Fe・NI(・Cr)などの金属は、希硝酸とは反応するが濃硝酸とは反応しません。
これは、「金属の表面に緻密な酸化被膜が生じ、内部を保護するため」です。(記述でもよく問われるので、このフレーズは覚えておきましょう。)
このように、金属が本来反応すべき状態であるのに、反応の進行が止まってしまう状態のことを不動態とよびます。


