この記事で学ぶこと
- 状態変化と熱
- 粒子間にはたらく力の大小と融点・沸点
状態変化とエネルギー
状態変化にともなうエネルギーは、主に熱エネルギー(熱量)として出入りします。
この記事では、5つの状態変化(融解・凝固・蒸発・凝縮・昇華)での熱量を見ていきます。
状態変化にともなう熱量の単位は、kJ/mol(1molあたりの熱量kJ)を使います。
融解熱・凝固熱(固体↔液体)
キーワード
- 融解熱:固体1molが液体になるときに吸収する熱量
- 凝固熱:液体1molが固体になるときに放出する熱量
どちらも固体と液体の状態変化の熱量なので、融解熱と凝固熱の値は等しくなります。
ここで、水の状態変化(固体→液体→気体)のグラフを見てみましょう。
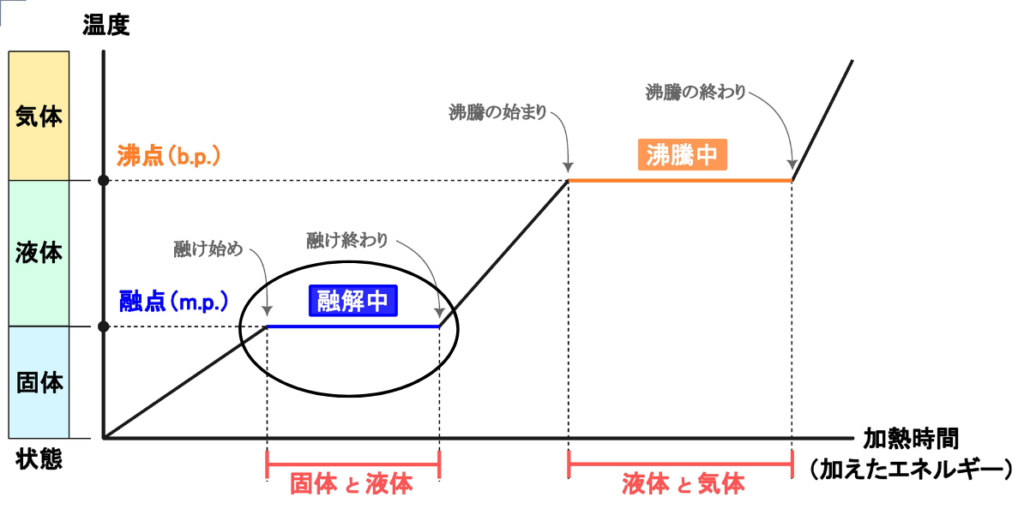
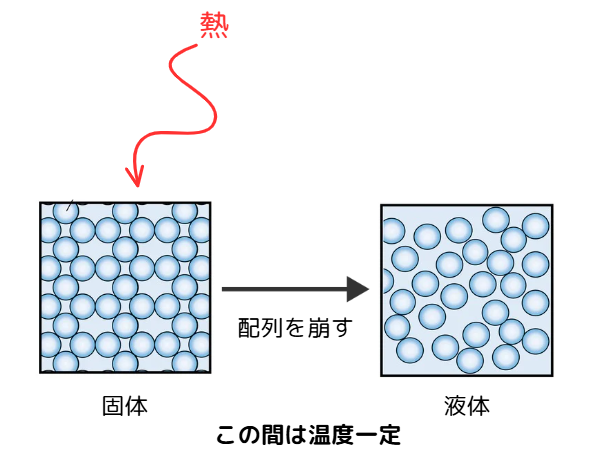
固体と液体間(融解中)で温度が一定に保たれている事がわかります。
これは、固体の粒子配列を崩すために熱が使われるからです。
蒸発熱・凝縮熱(液体↔気体)
キーワード
- 蒸発熱:液体1molが気体になるときに吸収する熱量
- 凝縮熱:気体1molが液体になるときに放出する熱量
どちらも液体と気体の状態変化の熱量なので、蒸発熱と凝固熱の値は等しくなります。
先ほどと同様に水の状態変化のグラフを見てみましょう。
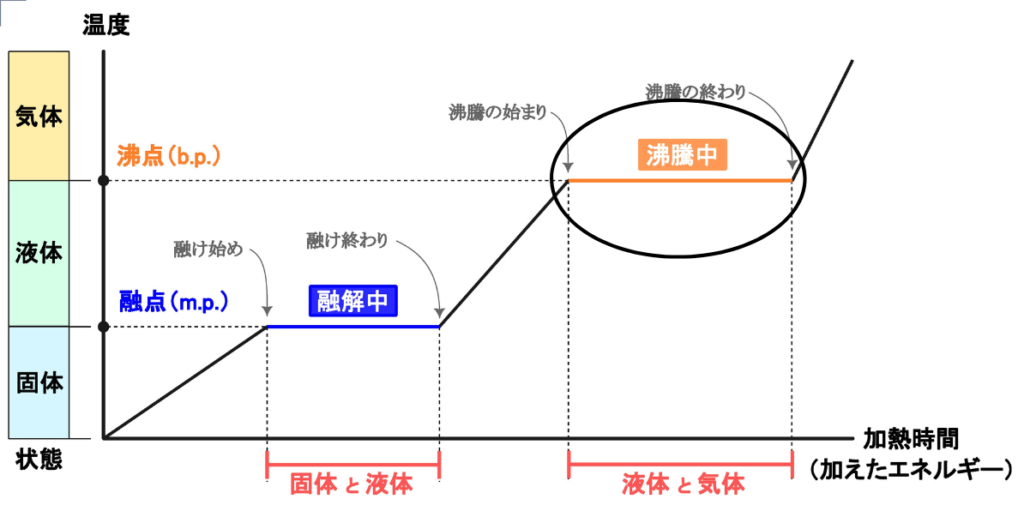
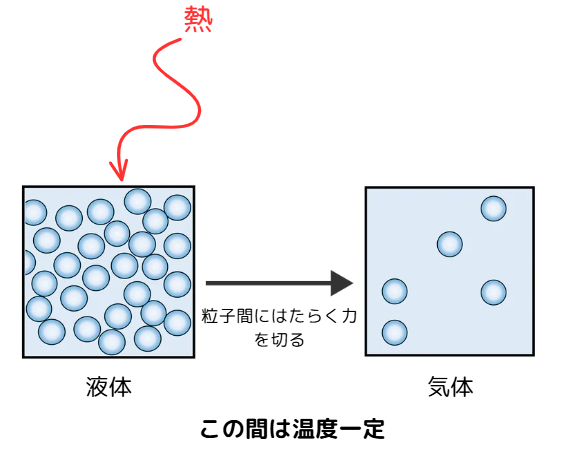
液体と固体間で温度が一定に保たれている事がわかります。
これは、液体分子の分子間力を振り切るために熱が使われるからです。
昇華熱(固体→気体)
キーワード
昇華熱:固体1molが気体になるときに吸収する熱量
昇華熱は、他4つと比べるとあまり入試では見ません。
しかし、後の単元(化学反応とエネルギー)で炭素や二酸化炭素(ドライアイス)の昇華熱を求める問題もあるので覚えておきましょう。
化学結合と融点・沸点
粒子間にはたらく力の強さは、その物質の融点と沸点に影響を与えます。
一般に、粒子間にはたらく力が大きいほど、融点・沸点が高くなります。
ここで、今まで勉強した粒子間にはたらく力の大小関係は以下のようになります。
共有結合 > イオン結合・金属結合 ≫ 水素結合 > ファンデルワールス力
具体的に、各力がはたらく物質の融点を見てみましょう
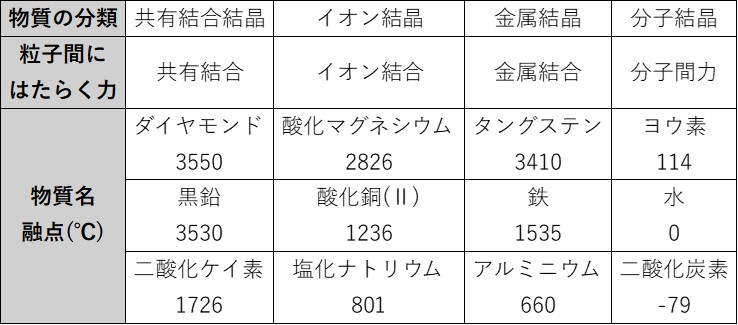
この表から、物質によってズレはあるものの上の大小関係が成り立っている事がわかります。
この記事を書いた人


