- 気液平衡
- 飽和と蒸気圧
- 沸騰の原理
- 状態図
気体分子の熱運動と圧力
ここでは、気体の圧力について見ていきます。
圧力:単位面積当たりにはたらく力。単位にはパスカルPaを用いる。
気体の圧力の場合、力を与えているのは気体分子です。
気体の圧力の原理を立方体中の気体分子を使って説明していきます。
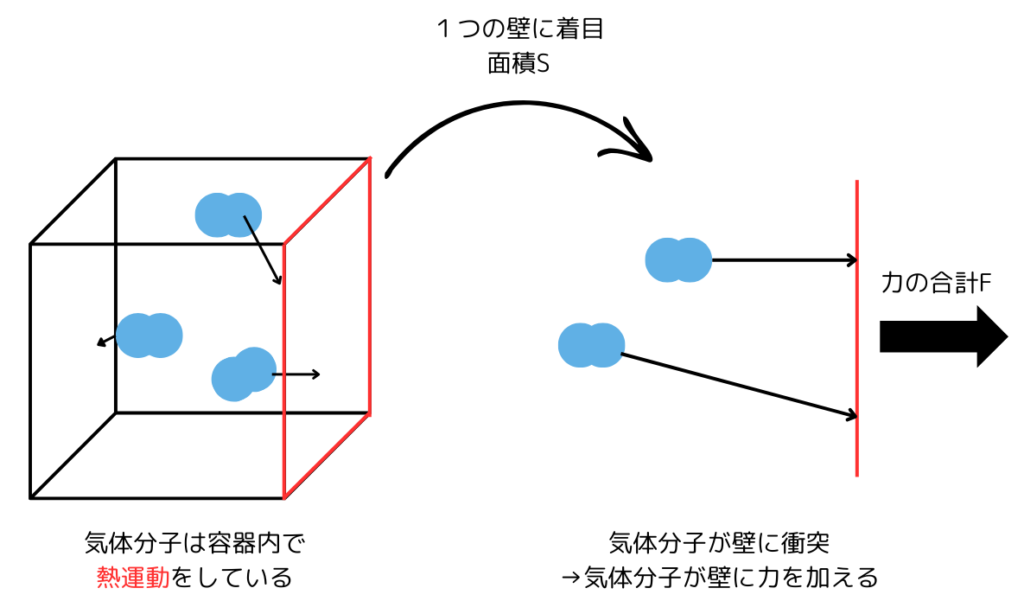
気体の圧力とは気体分子の衝突によって生じるものです。
上図の例の場合、気体の圧力は次のように求められます。
気体の圧力=\(\frac{気体分子が与える力の合計}{壁の面積}\)=\(\frac{F}{S}\)
気液平衡
液体分子の運動エネルギー
液体分子は、気体分子と同様に温度が高くなるほど運動エネルギーの高い分子の数の割合が増えます。
参考:物質の三態と熱運動(拡散・絶対温度・状態変化など)
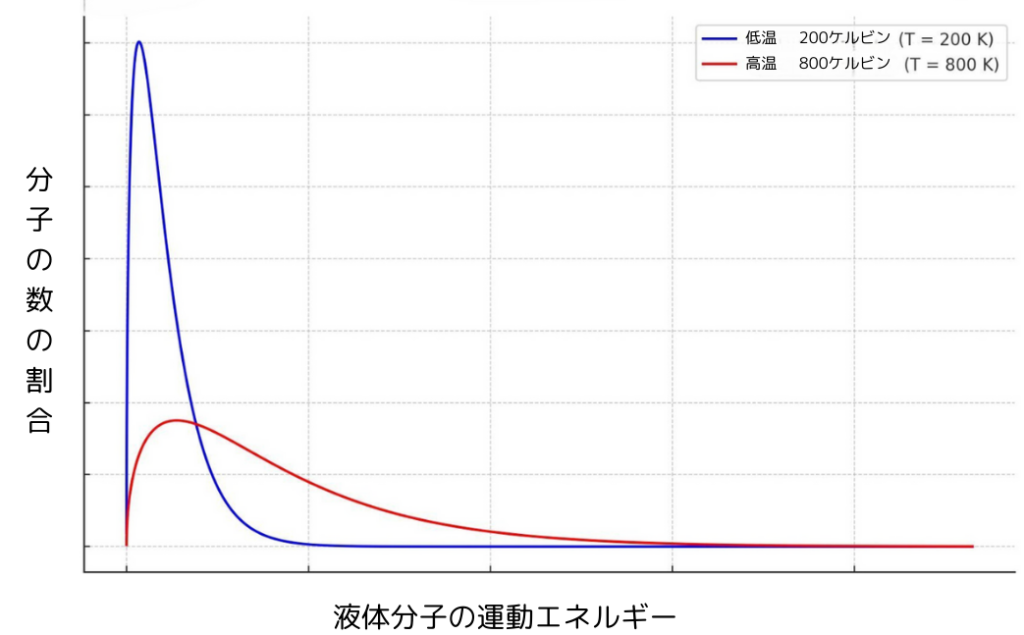
(このような分布をマクスウェル・ボルツマン分布と呼びます。)
気液平衡
温度一定の密閉容器内に液体を入れ十分時間が経つと、「液体が蒸発する量」と「気体が凝縮する量」が等しくなります。
このように、見かけ上蒸発も凝縮も起こっていない状態を気液平衡と呼びます。
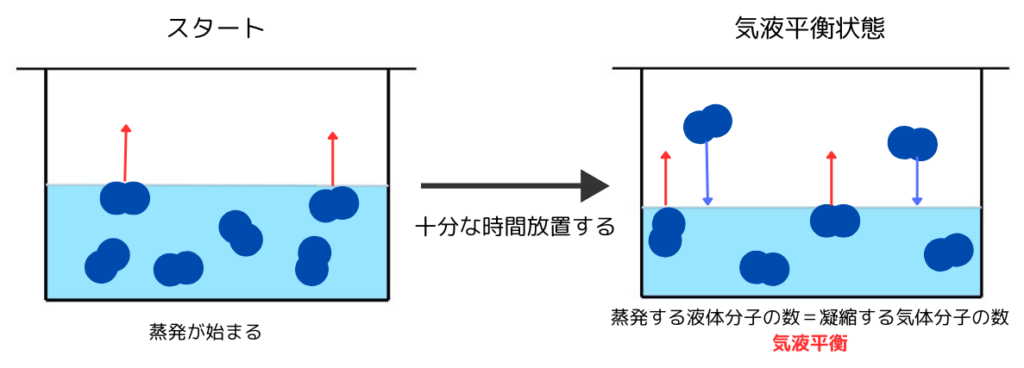
蒸気圧
物質が気液平衡にあるとき、容器内の気体には一定数の気体分子が存在します。
このときの気体が示す圧力を飽和蒸気圧(または単に蒸気圧)といいます。
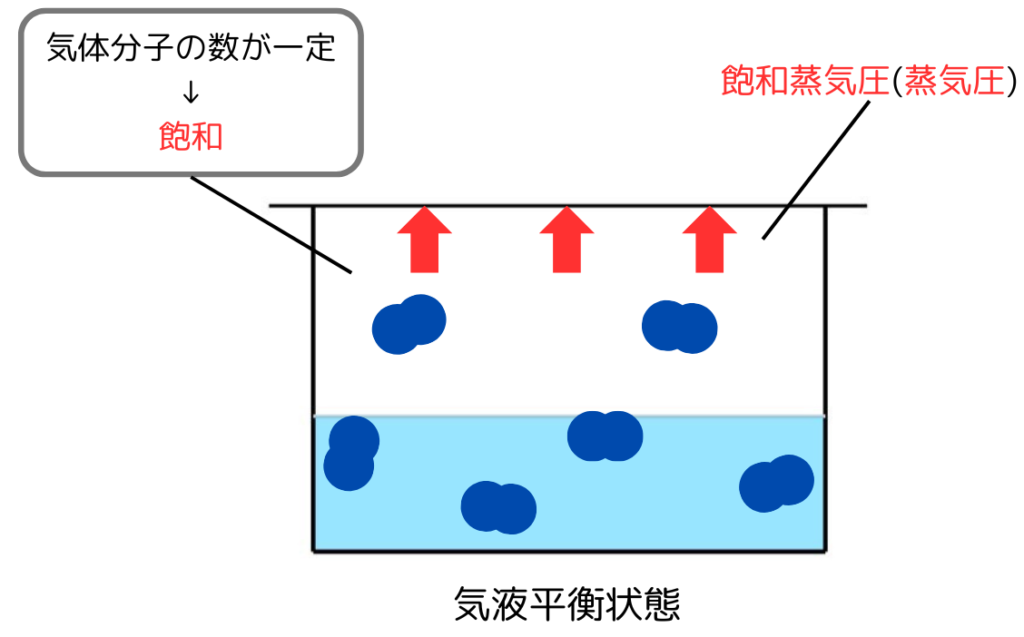
蒸気圧は気体分子が及ぼす圧力なので温度が高いほど気体分子の数が増え、蒸気圧が高くなります。
下のグラフは、蒸気圧と温度の関係を表す水の蒸気圧曲線です。
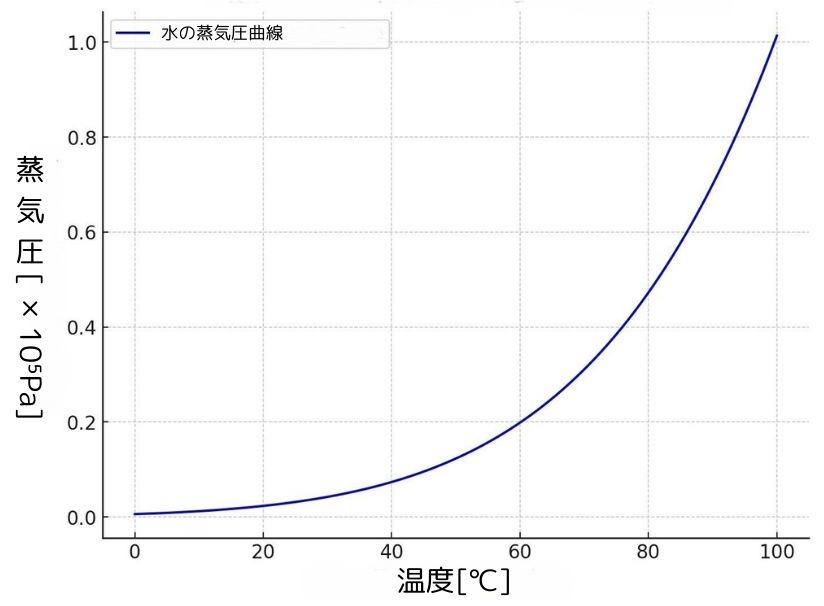
蒸気圧は定温で液体がある限り、容器の体積や液体の量に関係なく一定の値をとります。
蒸気圧と沸騰
ここで、沸騰についてより詳しく見ていきましょう。
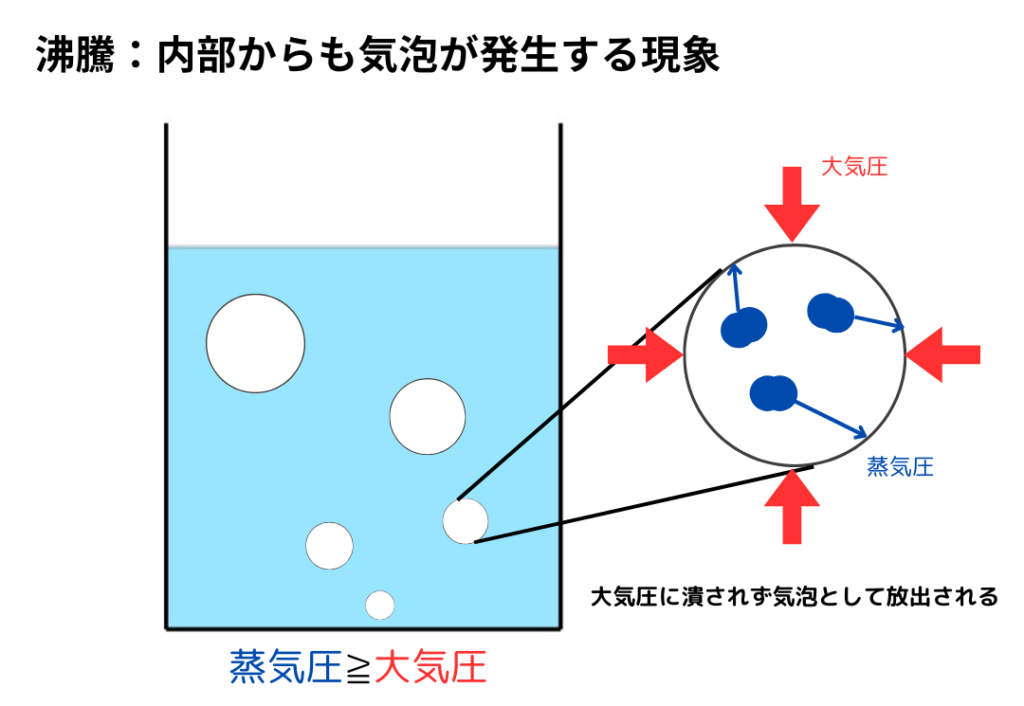
沸騰とは、液体の内部からも気泡が発生する現象のことでした。
沸騰の原理は蒸気圧と大気圧にあります。
- 蒸気圧<大気圧のとき:気泡は大気圧に押しつぶされて液体に戻る
- 蒸気圧≧大気圧のとき:気泡は大気圧に押しつぶされず大気中へ放出→沸騰
下の図は、沸騰の様子を表したものです。
分子が大気圧よりも強い力を持つことで、沸騰は起きます。
物質の状態図
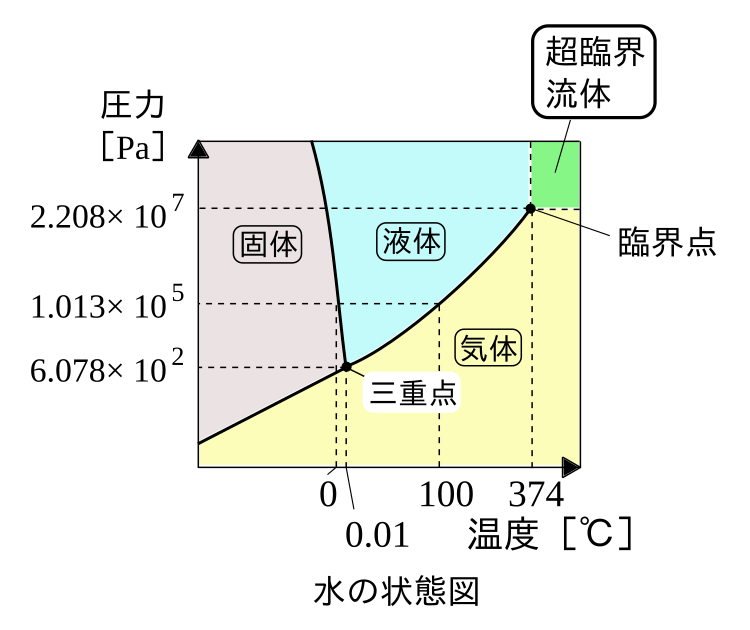
物質がある温度・圧力のときどのような状態にあるか表した図を物質の状態図といいます。
状態図の要素として、三重点・臨界点・超臨界流体を説明します。
- 三重点:固体・液体・気体が共存している状態
- 臨界点:蒸気圧曲線の終点
- 超臨界流体:液体と気体の中間的性質(流動性と拡散性)を持つ状態
ここで、水と二酸化炭素の状態図を見ていきます。
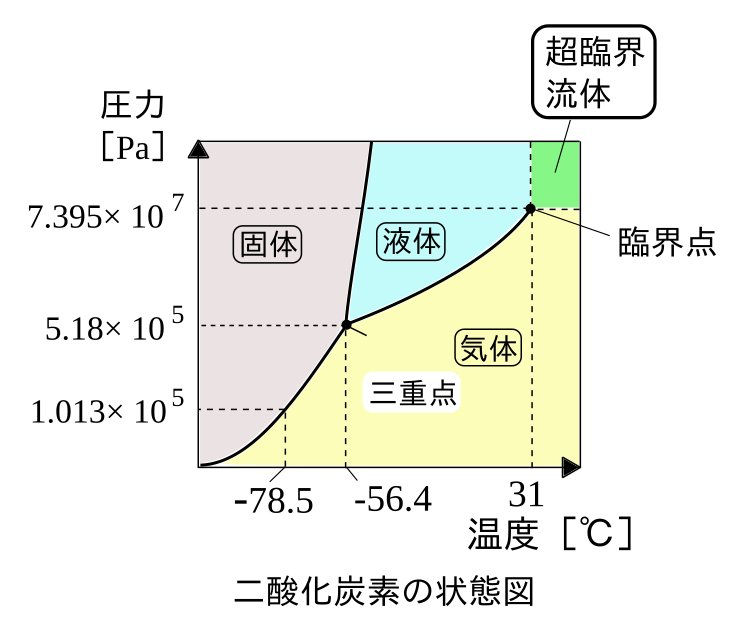
一般的な物質の状態図は右の二酸化炭素のようになります。
水の状態図は特異的で、融解曲線(固体・液体間の曲線)の傾きが負になっています。
つまり、氷に圧力を加えていくと水に変化していきます。


